ЕЛЕКТРОРУШІЙНІ СИЛИЕлектрод – це електрохімічна система, що складається мінімум з двох фаз, одна з яких зазвичай є провідником 1-го роду (метал або графіт), а друга – провідником 2-го роду (розчин або розплав електроліту). На межі поділу фаз перебігає рівноважний електродний процес переносу заряду з однієї фази до іншої, внаслідок чого виникає подвійний електричний шар, якому відповідає певний стрибок потенціалу – електродний потенціал. Цей стрибок потенціалу безпосередньо виміряти неможливо, проте можна виміряти різницю потенціалів між електродами. Електрод називається хімічно оборотним, якщо внаслідок зміни напряму струму на ньому перебігає у протилежних напрямках та ж сама реакція (наприклад, мідна пластинка, яка занурена в розчин з іонами З двох оборотних електродів можна скласти оборотний електрохімічний ланцюг або гальванічний елемент (ГЕ). В ГЕ катодом (+) є електрод з більшим значенням потенціалу, а анодом (–) – з меншим. На катоді завжди перебігає процес відновлення, а на аноді – окислення. Електрорушійною силою (ЕРС) гальванічного елементу називається різниця рівноважних потенціалів його електродів за умови відсутності струму в ланцюгу:
де Правила запису схем гальванічних елементів такі: - ліворуч розташовують анод, а праворуч – катод; - схема починається і закінчується символом металу; - розчини електролітів відокремлюються вертикальною пунктирною лінією у разі їх контакту через порувату мембрану і суцільною подвійною лінією, якщо між ними розміщено сольовий місток; - якщо в однаковому агрегатному стані перебувають декілька речовин, то їх відокремлюють комою; - необхідно зазначати концентрацію електроліту (або активності іонів) та парціальні тиски газів, які визначають потенціал електродів; - схему можна спростити, записуючи замість електроліту тільки іони, від яких залежить потенціал певного електрода. Прикладом хімічно оборотного ГЕ може бути елемент Даніеля-Якобі, який складається з цинкового та мідного електродів, що занурені відповідно у водні розчини сульфату цинку та сульфату міді:
або
При роботі цього гальванічного елементу перебігають такі електрохімічні реакції: на аноді (–) на катоді (+) сумарна реакція в ГЕ Якщо в ГЕ перебігає реакція
де Активність окремих іонів у складі сильного електроліту розраховують за рівнянням:
де Вираз для обчислення ЕРС елементу Даніеля-Якобі за (4.2) має вигляд:
Рівноважні потенціали окремих електродів
де Наприклад, для кобальтового електрода
Оскільки, як вже зазначалось раніше, потенціал електрода відносно розчину виміряти неможливо, то електродні потенціали у водних розчинах виражають в умовній водневій шкалі, в якій за будь-якої температури за нуль прийнято потенціал стандартного водневого електрода. Він являє собою покриту платиновою черню платинову пластину, яка занурена в розчин з одиничною активністю іонів водню. Електрод насичують очищеним та висушеним воднем з парціальним тиском 1 атм. На водневому електроді, схема якого записується як На практиці електродний потенціал визначають, користуючись (4.1), за виміряною ЕРС елементу, який складається з досліджуваного електрода та електрода порівняння з відомим значенням потенціалу. Найчастіше електродом порівняння обирають хлорсрібний Вимірювання ЕРС ГЕ повинно проводитись у термодинамічно оборотних умовах, тобто таких, за яких струм через ланцюг не проходить. Для цього використовують компенсаційний метод, в якому відома ЕРС еталонного гальванічного елементу (зазвичай елемент Вестона) врівноважує ЕРС досліджуваного ГЕ. Прилади для вимірювання ЕРС компенсаційним методом називаються потенціометрами. На теперішній час доволі часто замість потенціометрів застосовують високоомні вольтметри. За причиною виникнення струму в ланцюгу гальванічні елементи поділяють на хімічні та концентраційні. В хімічних гальванічних елементах ЕРС виникає внаслідок перебігу хімічної реакції. Електроди такого елементу мають різну хімічну природу. Прикладом хімічного ланцюга може слугувати елемент Даніеля-Якобі. Концентраційні ГЕ складаються з двох однакових за хімічною природою електродів, які відрізняються один від одного активностями (парціальними тисками) учасників електродних реакцій. Електричний струм в таких ланцюгах виникає внаслідок вирівнювання зазначених активностей (парціальних тисків). Стандартна ЕРС, яка дорівнює різниці стандартних потенціалів електродів
для концентраційного ГЕ дорівнює нулю. Якщо однакові електроди мають розчини з різними активностями іонів
|

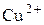 ).
). , (4.1)
, (4.1) – ЕРС ГЕ;
– ЕРС ГЕ;  – рівноважні потенціали катода і анода, відповідно.
– рівноважні потенціали катода і анода, відповідно.  вимірюються у вольтах (В).
вимірюються у вольтах (В).
 .
. ;
;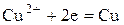 ;
; .
. , то його ЕРС можна обчислити за формулою:
, то його ЕРС можна обчислити за формулою: , (4.2)
, (4.2) – стандартна ЕРС ГЕ (ЕРС за умови одиничних активностей та парціальних тисків учасників реакції);
– стандартна ЕРС ГЕ (ЕРС за умови одиничних активностей та парціальних тисків учасників реакції);  – універсальна газова стала;
– універсальна газова стала; – абсолютна температура;
– абсолютна температура;  – стала Фарадея;
– стала Фарадея;  – число електронів, що беруть участь у реакції;
– число електронів, що беруть участь у реакції;  – нерівноважні (вихідні) активності реагентів;
– нерівноважні (вихідні) активності реагентів;  (за стандартної температури
(за стандартної температури  ).
). , (4.3)
, (4.3) – моляльна концентрація іонів даного типу
– моляльна концентрація іонів даного типу  ;
;  – середній іонний коефіцієнт активності електроліту з моляльною концентрацією
– середній іонний коефіцієнт активності електроліту з моляльною концентрацією  , до складу якого входить іон
, до складу якого входить іон  .
. , (4.4)
, (4.4)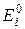 – стандартний електродний потенціал, тобто потенціал електрода за умови, що активності (парціальні тиски) всіх учасників електродної реакції дорівнюють одиниці;
– стандартний електродний потенціал, тобто потенціал електрода за умови, що активності (парціальні тиски) всіх учасників електродної реакції дорівнюють одиниці;  ,
,  – відповідно добутки нерівноважних активностей з урахуванням стехіометричних коефіцієнтів вихідних речовин та продуктів у реакції відновлення.
– відповідно добутки нерівноважних активностей з урахуванням стехіометричних коефіцієнтів вихідних речовин та продуктів у реакції відновлення.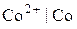 процес відновлення запишеться як
процес відновлення запишеться як  , а рівняння (4.4) матиме вигляд:
, а рівняння (4.4) матиме вигляд:
 , може перебігати в протилежних напрямках реакція
, може перебігати в протилежних напрямках реакція  . Отже, для експериментального визначення потенціалу електрода у водневій шкалі необхідно скласти гальванічний елемент з досліджуваного (в схемі він може бути як анодом, так і катодом) та стандартного водневого електродів і виміряти його ЕРС. Тоді з формули (4.1) випливає, що електродний потенціал – це ЕРС (або ЕРС з протилежним знаком) гальванічного елементу, який складається з досліджуваного та стандартного водневого електродів. Стандартні електродні потенціали у водневій шкалі за стандартної температури наведено у довідниках.
. Отже, для експериментального визначення потенціалу електрода у водневій шкалі необхідно скласти гальванічний елемент з досліджуваного (в схемі він може бути як анодом, так і катодом) та стандартного водневого електродів і виміряти його ЕРС. Тоді з формули (4.1) випливає, що електродний потенціал – це ЕРС (або ЕРС з протилежним знаком) гальванічного елементу, який складається з досліджуваного та стандартного водневого електродів. Стандартні електродні потенціали у водневій шкалі за стандартної температури наведено у довідниках. або каломельний
або каломельний 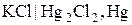 . Потенціал нормального каломельного електрода з концентрацією КСl 1 моль/дм3 за стандартної температури становить 0,281 В.
. Потенціал нормального каломельного електрода з концентрацією КСl 1 моль/дм3 за стандартної температури становить 0,281 В. , (4.5)
, (4.5) і
і  (
( ), які визначають потенціал, то теоретичне значення ЕРС концентраційного елементу можна розрахувати за рівнянням:
), які визначають потенціал, то теоретичне значення ЕРС концентраційного елементу можна розрахувати за рівнянням: . (4.6)
. (4.6)


