Кулонометричне титрування
Кулонометрія об'єднує методи аналізу, засновані на вимірюванні кількості електрики, витраченої в ході електродної реакції. Остання призводить до кількісного окиснення або відновлення речовини, що титрується, або ж до одержання проміжного компонента, що стехіометрично реагує зі сполукою, яка визначається. Основою методу кулонометричного аналізу є закон Фарадея, що встановлює зв'язок між кількістю речовини, що виділяється на електродах у процесі реакції,
де Q – кількість електрики, що, якщо сила току не змінюються з часом, дорівнює добутку сили струму на час його проходження через провідник; F - стала Фарадея (F= 96485 Кл/моль) чисельно дорівнює кількості електриці, при проходженні якої через електроліт на електроді виділяється еквівалентна маса речовини, z - число електронів, що приймає участь в електрохімічній реакції. Необхідна умова використання тієї або іншої електрохімічної реакції в кулонометричному аналізі полягає в тому, що практично вся електрика, що витрачається, йде лише на перетворення речовини, що визначається. Показником того, наскільки ця умова виконується, є величина, яка зветься виходом за струмом. Вихід за струмом h чисельно дорівнює відношенню маси практично виділеної речовини (
де Найбільш сучасним є варіант визначення, який зветься кулонометричним титруванням. В цьому методі, відрізняючись від класичного, титрант не дозують із бюретки, а електрохімічно продуцюють з розчину. Розглянемо окисно-відновне титрування. Для визначення відновників найбільш зручним титрантом, який продуцюється на генераторному електроді, є йод. З усіх відомих систем йод-йодидна є найбільш зворотною. Йод легко з 100-відсотковим виходом продуцюється, а йодидний іон відновлюється на благородних металах (платина, золото). Тому, якщо можливо підібрати спосіб визначення точки еквівалентності, з’являється можливість заміни традиційного титрування на сучасну електрохімічну швидку та зручну техніку. Кулонометричний аналіз має ряд істотних переваг у порівнянні з іншими фізико-хімічними методами аналізу (наприклад, надійне визначення надзвичайно малих концентрацій, легкість автоматизації, можливість використання нестійких реагентів, виключення використання стандартних розчинів, дозволяє проводити титрування у забарвлених розчинах). У сучасному кулонометричному титруванні не менш важливим, ніж генерація титранта, є підбір умов, за якими легко та чітко виявляється точка еквівалентності. Ці умови зручно реалізувати для йод-йодидної системи, якщо у якості катода в індикаторній електрохімічній системі використати благородний матеріал та нав’язати йому маленький негативний потенціал. Звичайно це здійснюється за умови нав’язування електрохімічної напруги на індикаторну пару зовнішнім джерелом напруги (поляризація). Що до другого електроду індикаторної пари (аноду), для виготовлення можливо використати більшість індиферентні матеріали. Але найбільш вигідним і простим є використання для нього провідного металу, нормальний потенціал якого нижчий за нормальний потенціал катоду. У такому випадку відпадає необхідність використання зовнішнього джерела поляризації. Така система індикації має назву біамперометрична, тому що у даному випадку вимірюється струм цієї гальванічної пари. На лабораторному практикумі у чотирьохелектродній титрувальній комірці два електроди призначені для генерації титранта (генераторні електроди), а інші два – для індикації кінця титрування. Щоб запобігти використання коштовних матеріалів для виготовлення генераторних електродів застосована нержавіюча сталь, індикаторного катода – скловуглець, індикаторного анода – ніхромовий дріт. Випробовування та використання цих матеріалів впродовж 20 років проводилося на кафедрі хімії і екології ХНТУ. На рис. 24 показаний прилад для йод-йодидного кулонометричного титрування з біамперометричною індикацією точки еквівалентності. ОСНОВНІ ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ: 1. Процес на генераторному аноді – утворення титранту: 2І– + КІ – 2 2. Процес на індикаторному катоді – індикація точки еквівалентності: КІ3 + 2 Допоміжні електрохімічні процеси:
3. Процес на генераторному катоді: 2Н+ + 2
4. Процес на індикаторному ніхромовому аноді: Ni – 2 Реакція в розчині при визначенні тіосульфатного йону: І2 + 2S2O32– = 2I– + S4O62–
Рис.24. Прилад для кулонометричного титрування: Г+ – основний генераторний електрод (нержавіюча сталь); Г– – допоміжний генераторний електрод (нержавіюча сталь); U– – основний індикаторний катод (скловуглець); U+ – допоміжний індикаторний електрод (ніхромовий дріт); мкА – мікроамперметр індикаторного ланцюга; мА – міліамперметр контролю генераторного струму; R – регулятор завдання генераторного струму. Лабораторна работа № 10 Кулонометричне визначення відновників. Визначення в розчині кількості тіосульфату натрію
Мета роботи: визначити в розчині кількість тіосульфату натрію кулонометричним титруванням. Прилади та реактиви: кулонометр, мішалка, секундомір, розчин з молярною концентрацією еквівалентів натрій тіосульфату (Na2S2O3) 0,01 моль/л; розчин з молярною концентрацією еквівалентів калій йодиду (КІ) 0,1 моль/л, піпетки на 1 мл, 2 мл, 5 мл. Методика виконання роботи 1. У комірку для титрування заливають 50 мл розчину з молярною концентрацією еквівалентів калій йодиду 0,1 моль/л, об'єм розчину в комірці доводять дистильованою водою до 150 мл (мітка на стакані). 2. Розчин підкислюють до рН = 4-5 оцтовою кислотою або будь-якою слабкою органічною кислотою (винна, лимонна). 3. Піпеткою вводять в комірку порцію титрату – 1 мл Na2S2O3. 4. Вмикають магнітну мішалку, тумблером "вкл." вмикають прилад. Тумблером "ген. струм" вмикають генераторний ланцюг і регулятором встановлюють необхідне значення генераторного струму за міліамперметром (10 мА). Одночасно вмикають секундомір та відмічають положення стрілки мікроамперметру. 5. Слідкують за її положенням до моменту, доки показник мікроамперметру зросте на чверть або на півділення шкали. Це буде кінцева точка титрування. При її досягненні вимикають секундомір і генераторний струм. 6. Розраховують кількість титрату за законом Фарадея. Дослід повторюють не менш трьох разів. При проведенні повторних вимірювань не має необхідності заміни робочого електроліту. Щоб не було помилок – не перетитровуйте! (Своєчасно вимикайте генераторний струм.) 7. Знаходять відносну помилку досліду. Якщо помилка не перевищує 5 %, проводять титрування 2 мл і 5 мл натрій тіосульфату. 8. Вирішують контрольні задачі. 9. Дані заносять у таблицю 27.
Таблиця 27 Результати кулонометричного титрування натрій тіосульфату
Питання та вправи для самоконтролю 1. Техніка кулонометричного йод-йодидного титрування: схема комірки, електродні і хімічні реакції. Індикація точки еквівалентності. 2. Які закони лежать в основі метода кулонометрії? 3. Які переваги кулонометричного аналізу при силі струму, що контролюється? 4. Кулонометричне титрування 3×10-5 молів натрій тіосульфату (Na2S2O3) при силі струму 0,01 А проводили 5 хвилин. Обчисліть відносну похибку досліду. 5. Кулонометричне титрування натрій тіосульфату струмом силою 10 мА проводили протягом 3 хвилин 15 секунд. Обчисліть кількість речовини. 6. Кулонометричне титрування 2×10-5 молів натрій тіосульфату (Na2S2O3) при силі струму 0,01 А проводили 3 хвилини 16 секунд. Обчисліть абсолютну похибку досліду. 7. Струм силою 2 А протягом 1 години 28 хвилин зумовив виділення на катоді (при 100%-му виході за струмом) 6,5 г металу. Обчисліть мольну масу еквіваленту металу. 8. Які електродні реакції відбуваються в йод-йодидному кулонометричному титруванні? 9. За 10 хвилин із розчину солі струм силою 5 А виділив 1,517 г платини. Визначте мольну масу еквіваленту металу. 4. Радіометричний метод аналізу У запропонованій роботі використовується природна радіоактивність калію, яка обумовлена тим, що до складу елемента калію входить радіоактивний ізотоп 40К, що є слабким β і γ – випромінювачем. Концентрація цього ізотопу в природному калії стала, тому вимір радіоактивності будь-якого природного об'єкта, що містить калій, дає можливість знайти його концентрацію, тому що залежність інтенсивності радіації від вмісту калію у зразку має лінійний характер. У якості приладу використовується радіометр, який чутливий до β і γ – випромінюванню. Лабораторна робота № 11 Визначення калій хлориду у суміші хлоридів. Роздільне визначення b– і g–випромінювань Мета роботи: визначити концентрацію калій хлориду у суміші хлоридів. Прилади та реактиви: радіометр, кристалічні солі калій хлориду і натрій хлориду, контейнер, тромбувач, секундомір.
|

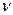 (моль) та кількістю витраченого при цьому електрики Q (Кл):
(моль) та кількістю витраченого при цьому електрики Q (Кл): ,
, , г) до маси, що повинна виділитися відповідно до закону Фарадея.
, г) до маси, що повинна виділитися відповідно до закону Фарадея.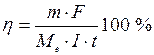
 – молярна маса еквівалентів речовини, що визначається. Ця формула є загальним виразом закону Фарадея. У кулонометричному аналізі розмір h повинен дорівнювати 1 або залишатися постійним поза залежністю від густини струму. У всіх розробках найбільша увага приділяється підбору умов, для того, щоб дотримати цих умов. Це склад електроліту, матеріали електродів, величина струму генерації та температура.
– молярна маса еквівалентів речовини, що визначається. Ця формула є загальним виразом закону Фарадея. У кулонометричному аналізі розмір h повинен дорівнювати 1 або залишатися постійним поза залежністю від густини струму. У всіх розробках найбільша увага приділяється підбору умов, для того, щоб дотримати цих умов. Це склад електроліту, матеріали електродів, величина струму генерації та температура. = КІ3
= КІ3



