Задачи для самостоятельного решения. 1. Концентрация газа равна 0,125 моль/л1. Концентрация газа равна 0,125 моль/л. Какой станет концентрация газа: а) при увеличении объема в 5 раз; б) при уменьшении объема в 3 раза? Ответ: а) 0,025 моль/л; б) 0,375 моль/л. 2. Реакция протекает по уравнению Fe2O3(т) + 3CO(r) = 2Fe(т) + + 3СО2. Как надо изменить концентрацию СО и давление в системе, чтобы увеличить выход металла? Ответ: Увеличить концентрацию СО; давление не влияет. 3. Окисление сернистого газа протекает по уравнению 2SO2 + О2 = 2SO3 + 284 кДж. Как следует изменить концентрацию исходных веществ и температуру для усиления процесса окисления? Ответ: Увеличить концентрации SO2 и О2, понизить температуру. 4. Реакция протекает по уравнению Nа2S2О3(ж) + Н2SО4(ж) = Nа2SО3(ж) + S(n) + Н2О. Как изменится скорость реакции при разбавлении реагирующей смеси в 2 раза? Ответ: Уменьшится в 4 раза. 5. Во сколько раз увеличится скорость химической реакции при повышении температуры на 100 °С, принимая температурный коэффициент скорости равным 3? Ответ: Увеличится в 59 049 раз. 6. При 20 °С реакция протекает за 2 минуты. За сколько времени будет протекать эта же реакция: а) при 0 °С; б) при 50 °С, принимая температурный коэффициент реакции равным 2? Ответ: а)за 8мин; б) за 15 с. 7. Определить температурный коэффициент химической реакции, если при понижении температуры на 40 °С реакция замедлилась в 40 раз? Ответ: 2,5. 8.Реакция идет по уравнению N2 + О2 = 2NO. Концентрации исходных веществ были (моль/л): азота – 0,049 и кислорода – 0,01. Вычислите концентрации участвующих в реакции веществ в момент, когда концентрация продукта реакции стала 0,005 моль/л. Ответ: N2 – 0,0465 моль/л; 02 – 0,0075 моль/л. 9. Окисление аммиака идет по уравнению 4NH3 + 5О2 =4NO + 6Н2О. Через некоторое время после начала реакции концентрации участвующих в ней веществ были (моль/л): аммиака – 0,009, кислорода – 0,00125, оксида азота (II) – 0,003. Вычислить: а) концентрацию водяного пара в этот момент; б) исходные концентрации аммиака и кислорода. Ответ: а) Н2О – 0,0045 моль/л; б) NH3 – 0,012 моль/л, О2 – 0,005 моль/л. 10. Реакция протекает по уравнению 4НС1(г) + О2(г) = 2С12(г) + 2Н2О(п). Через некоторое время после начала реакции установились концентрации (моль/л): хлороводорода – 0,85, кислорода – 0,44, хлора – 0,3. Рассчитайте начальные концентрации исходных веществ. Ответ: HCI – 1,45 моль/л; О2 – 0,59 моль/л. 11. В процессе реакции, протекающей по уравнению 2А + 3В = С за определенный период времени концентрация вещества А уменьшилась на 0,3 моль/л. Как изменилась при этом концентрация вещества В? Ответ: Уменьшилась на 0,45 моль/л. 12. При синтезе аммиака 3Н2 + N2 = 2NH3 к данному моменту времени прореагировало 0,9 моль/л водорода, а начальная концентрация была равна 1,4 моль/л. Определите концентрацию оставшегося водорода и прореагировавшего азота. Ответ: Н2 – 0,5 моль/л; N2 – 0,3 моль/л. 13. Исходные концентрации сернистого газа и кислорода в гомогенной системе 2SO2 + O2=2SO3 были соответственно равны 0,03 и 0,015 моль/л. К моменту наступления равновесия концентрация сернистого газа стала равной 0,01 моль/л. Вычислите равновесные концентрации остальных веществ, участвующих в реакции. Ответ: О2 – 0,005 моль/л; SO3 – 0,02 моль/л. 14. Реакция протекает по уравнению Н2(г) + I2(г) = 2HI(г). Константа скорости реакции равна 0,16. Начальные концентрации исходных веществ были (моль/л): водорода – 0,04, паров йода – 0,05. Вычислите начальную скорость реакции и скорость ее, когда концентрация водорода стала равной 0,03 моль/л. Ответ: 3,2.10–4 моль/л·с; 1,9 · 10–4 моль/л·с. 15. Омыление уксусноэтилового эфира протекает по уравнению СН3СООС2Н5(ж) + NaОН(ж) = СН3СООNa(ж) + С2H5ОН(ж). Константа скорости реакции равна 0,1. Начальные концентрации исходных веществ (моль/л): эфира – 0,01, щелочи – 0,05. Вычислите начальную скорость реакции v искорость ее, когда концентрация эфира стала равной 0,008 моль/л. Ответ: 5 · 10–5 моль/л·с; 3,84 · 10–5 моль/л·с. 16. Для обратимых систем а) 3О2 = 2О3; б) N2 + О2 = 2NO; в) 2SO2 + O2 = 2SО3 напишите математическое выражение константы химического равновесия (Кх.р) и определите, в какой из систем изменение давления не будет вызывать смещение равновесия. Ответ: а) Кр = 17. Изменением каких параметров (концентрация, давление, температура) можно добиться смещения равновесия в сторону образования продукта реакций: а) Н2(г) + Вr2(г) = 2НВr(г) + 68 кДж; б) 2SO2(г) + О2(г) = 2SО3(r) + 284 кДж; в) С(т) + СО2(г) = 2СО(г) – 172 кДж? Ответ: Повысить концентрации исходных газообразных веществ: а), б), в); давление повысить: б); – понизить: в); температуру повысить: в) – понизить: а), б). 18. Как повлияет на выход метилового спирта в обратимой реакции СО(г)+ 2Н2 = СН3ОН(ж) + 128 кДж и куда будет смещаться равновесие при: а) увеличении объема системы; б) повышении концентрации водорода; в) введении катализатора? Ответ: а) снижение выхода продукта, смещение равновесия влево; б) увеличение выхода продукта, смещение равновесия вправо; в) не влияет. 19. Как изменятся скорости прямой и обратной реакций и в какую сторону сместится равновесие обратимой системы SO3(г) + С(т) = SО2(г) + СО(г) при увеличении объема системы в 8 раз? Ответ: Скорость прямой реакции превысит скорость обратной реакции в 8 раз; равновесие сместится вправо. 20. Как изменятся скорости реакций при увеличении давления а) 4NO2(r) + O2(r) + 2H2O(r) = 4HNO3(ж); б) 8NH3(r) + Br2(ж) = 6NH4Br(т) + N2(г)? Ответ: Скорость увеличится: а) в 128 раз; б) в 256 раз.
|

 ; б) Кр =
; б) Кр = 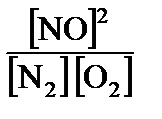 ; в) Кр =
; в) Кр =  .
.


