6.1. При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции 2NO2  2NO + O2 установилось при следующих концентрациях (моль/л): [NO2] = 0,4; [NO] = 1; [O2] = 0,5. Вычислить константу равновесия для этой температуры и исходную концентрацию диоксида азота.
2NO + O2 установилось при следующих концентрациях (моль/л): [NO2] = 0,4; [NO] = 1; [O2] = 0,5. Вычислить константу равновесия для этой температуры и исходную концентрацию диоксида азота.
(Ответ: 3,125; 1,4 моль/л).
6.2. Реакция протекает по уравнению АВ  А + В. При некоторой температуре из 1 моль АВ, находящегося в закрытом сосуде емкостью 20 л, разлагается 0,6 моль АВ. Определить константу равновесия. (Ответ: 0,045).
А + В. При некоторой температуре из 1 моль АВ, находящегося в закрытом сосуде емкостью 20 л, разлагается 0,6 моль АВ. Определить константу равновесия. (Ответ: 0,045).
6.3. Константа равновесия реакции N2O4  2NO2 равна 0,16 при 375 К. Равновесная концентрация NO2 равна 0,09 моль/л. Вычислить равновесную концентрацию N2O4. (Ответ: 0,051 моль/л).
2NO2 равна 0,16 при 375 К. Равновесная концентрация NO2 равна 0,09 моль/л. Вычислить равновесную концентрацию N2O4. (Ответ: 0,051 моль/л).
6.4. Рассчитать равновесную концентрацию О3 и константу равновесия в реакции 3О2 (г)  2О3 (г), если начальная масса О2 равна 24 г, а равновесная концентрация О2 равна 0,6 моль/л. (Ответ: 0,1 моль/л; 0,046).
2О3 (г), если начальная масса О2 равна 24 г, а равновесная концентрация О2 равна 0,6 моль/л. (Ответ: 0,1 моль/л; 0,046).
6.5. Используя справочные данные табл. Б. 1, рассчитать Δ Н° х.р. реакции, протекающей по уравнению 2NO2 (г)  2NO (г) + O2 (г) и определить, в какую сторону сместится равновесие при охлаждении системы.
2NO (г) + O2 (г) и определить, в какую сторону сместится равновесие при охлаждении системы.
6.6. Рассчитать равновесные концентрации газообразных веществ в гетерогенной системе FeO (к) + CO (г)  Fe (к) + CO2 (г), если начальная концентрация СО составляла 2 моль/л, константа равновесия К С = 0,6.
Fe (к) + CO2 (г), если начальная концентрация СО составляла 2 моль/л, константа равновесия К С = 0,6.
(Ответ: 1,25; 0,75 моль/л.).
6.7. При состоянии равновесия в системе N2 + 3H2  2NH3 концентрации веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4. Рассчитать, как изменятся скорости прямой и обратной реакции, если концентрации всех участвующих в реакции веществ увеличить в 4 раза. В каком направлении сместится равновесие? (Ответ: 256; 16).
2NH3 концентрации веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4. Рассчитать, как изменятся скорости прямой и обратной реакции, если концентрации всех участвующих в реакции веществ увеличить в 4 раза. В каком направлении сместится равновесие? (Ответ: 256; 16).
6.8. Вычислить константу равновесия для гомогенной системы
CO (г) + H2O (г)  СO2 (г) + H2 (г), если равновесные концентрации реагирующих веществ (моль/л): [CO] = 0,004; [H2O] = 0,064; [CO2] = 0,016, [H2] = 0,016. Чему равны исходные концентрации воды и СО?
СO2 (г) + H2 (г), если равновесные концентрации реагирующих веществ (моль/л): [CO] = 0,004; [H2O] = 0,064; [CO2] = 0,016, [H2] = 0,016. Чему равны исходные концентрации воды и СО?
(Ответ: 1; 0,08 моль/л; 0,02 моль/л).
6.9. В начальный момент протекания реакции NiO (к) + Н2 (г)  Ni (к) + H2O (г) концентрации были равны (моль/л):
Ni (к) + H2O (г) концентрации были равны (моль/л):  = 0,5;
= 0,5;  = 1,7. Рассчитать равновесные концентрации газообразных веществ, если К С = 5,66.
= 1,7. Рассчитать равновесные концентрации газообразных веществ, если К С = 5,66.
(Ответ: 0,33; 1,87 моль/л).
6.10. В реакторе при некоторой температуре протекает реакция
СО2 + Н2  СО + Н2О. Определить константу равновесия, если в начальный момент
СО + Н2О. Определить константу равновесия, если в начальный момент  = 2,15 моль/л,
= 2,15 моль/л,  = 1,25 моль/л, а к моменту равновесия прореагировало 60 % начального количества СО2. (Ответ: 0,8).
= 1,25 моль/л, а к моменту равновесия прореагировало 60 % начального количества СО2. (Ответ: 0,8).
6.11. Определить, в какую сторону произойдет смещение равновесия реакции CO2 (г) + 4Н2 (г)  СН4 (г) + 2Н2О (г), ∆ Н° х.р. = –165 кДж при следующих воздействиях: а) увеличении давления; б) повышении концентрации СО2; в) понижении температуры.
СН4 (г) + 2Н2О (г), ∆ Н° х.р. = –165 кДж при следующих воздействиях: а) увеличении давления; б) повышении концентрации СО2; в) понижении температуры.
6.12. В гомогенной системе установилось равновесие 2H2S + 3O2  2SO2 + 2H2O. Константа равновесия К С = 3∙105. Исходные вещества или продукты реакции будут преобладать в равновесной смеси веществ? Вычислить равновесную концентрацию диоксида серы, если равновесные концентрации веществ, участвующих в реакции, равны (моль/л): [H2S] = 0,02; [O2] = 0,30; [H2O] = 0,40. (Ответ: 4,5 моль/л).
2SO2 + 2H2O. Константа равновесия К С = 3∙105. Исходные вещества или продукты реакции будут преобладать в равновесной смеси веществ? Вычислить равновесную концентрацию диоксида серы, если равновесные концентрации веществ, участвующих в реакции, равны (моль/л): [H2S] = 0,02; [O2] = 0,30; [H2O] = 0,40. (Ответ: 4,5 моль/л).
6.13. Рассчитать КС реакции PCl5 (г)  PCl3 (г) + Cl2 (г) при 500 К, если к моменту равновесия разложилось 54 % PCl5, а исходная концентрация PCl5 была равна 1 моль/л. (Ответ: 0,634).
PCl3 (г) + Cl2 (г) при 500 К, если к моменту равновесия разложилось 54 % PCl5, а исходная концентрация PCl5 была равна 1 моль/л. (Ответ: 0,634).
6.14. После смешивания газов А и В в системе А (г) + В (г)  С (г) +D (г) устанавливается равновесие при следующих концентрациях: [B] = 0,5 моль/л; [C] = 0,2 моль/л. Константа равновесия реакции равна 4×10-2. Найти исходные концентрации вещества А и В. (Ответ: 2,2; 0,7 моль/л).
С (г) +D (г) устанавливается равновесие при следующих концентрациях: [B] = 0,5 моль/л; [C] = 0,2 моль/л. Константа равновесия реакции равна 4×10-2. Найти исходные концентрации вещества А и В. (Ответ: 2,2; 0,7 моль/л).
6.15. Система С (графит) + СО2 (г)  2СО (г), D Н° х.р. = 172,5 кДж находится в состоянии равновесия. Как повлияет на равновесие системы: а) повышение температуры; б) понижение давления; в) понижение концентрации СО2?
2СО (г), D Н° х.р. = 172,5 кДж находится в состоянии равновесия. Как повлияет на равновесие системы: а) повышение температуры; б) понижение давления; в) понижение концентрации СО2?
6.16. При некоторой температуре равновесные концентрации в системе
2SO2 + O2  2SO3 составляли (моль/л): [SO2] = 0,04; [O2] = 0,06; [SO3] = 0,02. Определить константу равновесия и исходные концентрации SO2 и O2.
2SO3 составляли (моль/л): [SO2] = 0,04; [O2] = 0,06; [SO3] = 0,02. Определить константу равновесия и исходные концентрации SO2 и O2.
(Ответ: 4,17; 0,06 моль/л; 0,07 моль/л).
6.17. Реакция протекает по уравнению NO + Cl2  NOCl2, D Н < 0.
NOCl2, D Н < 0.
Какие изменения а) температуры; б) давления; в) концентраций участвующих в реакции веществ способствуют увеличению выхода продукта реакции?
6.18. Константа равновесия реакции FeO (к) + СО (г)  Fe (к) + СО2 (г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л):
Fe (к) + СО2 (г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л): 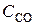 = 0,08;
= 0,08;  = 0,02. (Ответ: 0,67; 0,33 моль/л).
= 0,02. (Ответ: 0,67; 0,33 моль/л).
6.19. Система N2 (г) + 3Н2 (г)  2NH3 (г); D Н°х.р. = –92,4 кДж
2NH3 (г); D Н°х.р. = –92,4 кДж
находится в состоянии равновесия. Определить, в каком направлении сместится равновесие: а) с ростом температуры; б) при повышении давления; в) при понижении концентрации NH3.
6.20. Найти константу равновесия реакции
N2O4  2NO2,
2NO2,
если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия разложилось 50 % N2O4. (Ответ: 0,16).

 2NO + O2 установилось при следующих концентрациях (моль/л): [NO2] = 0,4; [NO] = 1; [O2] = 0,5. Вычислить константу равновесия для этой температуры и исходную концентрацию диоксида азота.
2NO + O2 установилось при следующих концентрациях (моль/л): [NO2] = 0,4; [NO] = 1; [O2] = 0,5. Вычислить константу равновесия для этой температуры и исходную концентрацию диоксида азота. СO2 (г) + H2 (г), если равновесные концентрации реагирующих веществ (моль/л): [CO] = 0,004; [H2O] = 0,064; [CO2] = 0,016, [H2] = 0,016. Чему равны исходные концентрации воды и СО?
СO2 (г) + H2 (г), если равновесные концентрации реагирующих веществ (моль/л): [CO] = 0,004; [H2O] = 0,064; [CO2] = 0,016, [H2] = 0,016. Чему равны исходные концентрации воды и СО? = 0,5;
= 0,5;  = 1,7. Рассчитать равновесные концентрации газообразных веществ, если К С = 5,66.
= 1,7. Рассчитать равновесные концентрации газообразных веществ, если К С = 5,66. = 1,25 моль/л, а к моменту равновесия прореагировало 60 % начального количества СО2. (Ответ: 0,8).
= 1,25 моль/л, а к моменту равновесия прореагировало 60 % начального количества СО2. (Ответ: 0,8).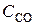 = 0,08;
= 0,08; 


