Для второго электродаj Ag+/Ag = j ° Ag+/Ag + 0,059 lg 10-4 = 0,799 + 0,059×(–4) = 0,563 В. Первый электрод с большим значением потенциала в данном элементе является катодом, второй – анодом. ЭДС рассчитываем по формуле E = j к – j а = 0,74 – 0,563 = 0,177 В. Пример 12.2. Рассчитать ЭДС элемента Cd½Cd2+ || Ni2+½Ni при концентрации ионов Cd2+ и Ni2+, равных соответственно 0,1 и 0,001 моль/л. Решение. Используя уравнения Нернста и данные таблицы стандартных электродных потенциалов, рассчитываем электродные потенциалы Cd и Ni: j Сd2+/Cd = j ° Сd2+/Cd + j Ni2+/Ni = j ° Ni2+/Ni + Так как j Сd2+/Cd < j Ni2+/Ni, то токообразующей в этом гальваническом элементе является реакция Cd0 + Ni2+ = Cd2+ + Ni0. Рассчитываем ЭДС элемента E = j Ni2+/Ni – j Сd2+/Cd = –0,2795 – (–0,4915) = 0,212 В. Пример 12.3. Исходя из значений стандартных электродных потенциалов и D G °х.р., указать, можно ли в гальваническом элементе осуществить реакцию Pb2+ + Ti = Pb + Ti2+. Составить схему гальванического элемента, написать уравнения электродных реакций. Решение. В соответствии с уравнением реакции схему гальванического элемента можно представить следующим образом: (–) Ti½Ti2+|| Pb2+½Pb (+). Уравнения электродных реакций имеют вид: на аноде Ti0 – 2ē ® Ti2+ на катоде Pb2++ 2ē ® Pb0 Рассчитываем стандартное значение ЭДС: E° = j ° к – j ° а = j ° Pb2+/Pb – j ° Ti2+/Ti = –0,126 – (–1,628) = 1,502 B. Энергию Гиббса рассчитываем по уравнению D G = –nE°F = –2×1,502×96500 = = –289,9 кДж. Так как D G° < 0, токообразующая реакция возможна. Пример 12.4. Как изменится масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составить молекулярные и ионные уравнения соответствующих реакций. Решение. В соответствии со значениями стандартных электродных потенциалов ионы меди и свинца по отношению к цинку будут проявлять окислительную активность. При контакте с растворами CuSO4 и Pb(NO3)2 будут протекать реакции растворения цинка и осаждения соответствующего металла: а) CuSO4 + Zn = Cu + ZnSO4, Cu2+ + Zn = Cu + Zn2+; б) Pb(NO3)2 + Zn = Pb + Zn(NO3)2, Pb2+ + Zn = Pb + Zn2+. Один моль эквивалентов цинка (32,69 г/моль) будет замещаться на один моль эквивалентов меди (31,77 г/моль) или свинца (103,6 г/моль). Учитывая молярные массы эквивалентов этих элементов, в растворе CuSO4 масса цинковой пластины будет незначительно уменьшаться, а в растворе Pb(NO3)2 – заметно увеличиваться. Стандартный потенциал магния имеет меньшее значение, чем потенциал цинка. Это означает, что ионы магния не могут окислять цинковую пластинку. Поведение цинка в таком растворе аналогично окислению цинковой пластинки в воде: Zn – 2ē = Zn2+. Протекание такого процесса приведет к малозаметному снижению массы цинковой пластинки. Пример 12.5. Как происходит коррозия цинка, находящегося в контакте с кадмием, во влажном воздухе и в кислом растворе (НСl)? Составить уравнения анодного и катодного процессов. Привести схемы образующихся при этом гальванических элементов. Определить состав продуктов коррозии. Решение. Цинк имеет меньшее значение потенциала (–0,763 В), чем кадмий (–0,403 В), поэтому он является анодом, а кадмий – катодом. Следовательно, цинк растворяется, а на поверхности кадмия идет восстановление: в кислом растворе – ионов водорода, во влажном воздухе – растворенного в воде кислорода. Анодный процесс Zn – 2ē = Zn2+. Катодный процесс 2Н+ + 2ē ® Н2 (в кислом растворе); О2 + 2Н2О + 4ē ® 4ОН– (во влажном воздухе). Схема образующегося гальванического элемента во влажном воздухе: (–) Zn | O2, H2O½Cd (+). Схема образующегося гальванического элемента в кислом растворе: (–) Zn½HCl½Cd (+). Во влажном воздухе ионы Zn2+ с гидроксильными группами, выделяющимися на катоде, образуют малорастворимый гидроксид цинка Zn(ОН)2, который и является продуктом коррозии. В кислой среде на поверхности кадмия выделяется газообразный водород. В раствор переходят ионы Zn2+. Пример 12.6. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадает в кислую среду (HCl)? Привести уравнения анодного и катодного процессов, схему образующегося гальванического элемента. Каков состав продуктов коррозии? Решение. По положению в ряду напряжений металлов видно, что хром более активный металл (j ° Сr3+/Cr = –0,744 В), чем медь (j ° Сu2+/Cu = 0,337 В). В образованной гальванической паре Cr – анод, он окисляется, а Cu – катод, на ее поверхности выделяется (восстанавливается) водород из HCl. Анодный процесс: Cr –3ē = Cr3+ Катодный процесс в кислой среде: 2Н+ + 2ē ® Н2 Схема гальванического элемента: (–) Cr½HCl½Cu (+) Появляющиеся ионы Cr3+ образуют с хлорид-анионами (из HCl) растворимое соединение – CrC13, на поверхности меди выделяется Н2.
|

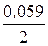 lg 10-3 = –0,403 + 0,0295×(–3) = –0,4915 В;
lg 10-3 = –0,403 + 0,0295×(–3) = –0,4915 В;


