Фазовые диаграммы.Фазовые переходы. Уравнение Клапейрона-Клаузиуса. Понятие фаза в термодинамике рассматривают в более широком смысле, чем агрегатные состояния. Согласно [5], под фазой в термодинамике понимают термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Иногда неравновесное метастабильное состояние вещества также называют фазой, но метастабильной. Фазы вещества могут отличаться характером движения структурных частиц и наличием или отсутствием упорядоченной структуры. Различные кристаллические фазы могут отличаться друг от друга типом кристаллической структуры, электропроводностью, электрическими и магнитными свойствами и др. Жидкие фазы отличаются друг от друга концентрацией компонентов, наличием или отсутствием сверхпроводимости и т.п. Переход вещества из одной фазы в другую называется фазовым переходом. К фазовым переходам относятся явления парообразования и плавления, конденсации и кристаллизации и др.. В двухфазной системе фазы находятся в равновесии при одной и той же температуре. При увеличении объёма некоторая часть жидкости превращается в пар, но при этом для поддержания температуры неизменной необходимо извне передать некоторое количество теплоты. Таким образом, для осуществления перехода из жидкой фазы в газообразную системе необходимо передать теплоту без изменения температуры системы. Эта теплота идёт на изменение фазового состояния вещества и называется теплотой фазового превращения или скрытой теплотой перехода. С повышением температуры скрытая теплота перехода фиксированной массы вещества уменьшается, а при критической температуре она равна нулю. Для характеристики фазового перехода используют удельную теплоту фазового перехода. Удельной теплотой фазового перехода называется количество скрытой теплоты, приходящейся на единицу массы вещества. Фазовые переходы с поглощением или выделением скрытой теплоты перехода называются фазовыми переходами первого рода. При этом внутренняя энергия и плотность изменяются скачком. При переходе из более упорядоченного состояния в менее упорядоченное состояние энтропия увеличивается. В таблице 5.1 приведены фазовые переходы первого рода и их основные характеристики. Существует связь между давлением, при котором находится в равновесии двухфазная система, и температурой при фазовых переходах первого рода. Эта связь описывается уравнением Клапейрона – Клаузиуса. Рассмотрим вывод этого уравнения для закрытых систем. Если число частиц в системе постоянно, то изменение внутренней энергии, согласно первому началу термодинамики, определяется выражением: Таблица 5.1. Фазовые переходы первого рада и их основные характеристики
Предположим, что цикл реализован для системы, масса вещества которой равна единице. Коэффициент полезного действия такого элементарного цикла Карно можно определить по формулам:
Уравнение (5.23) называется уравнением Клапейрона – Клаузиуса. Анализируя это уравнение, можно заключить, что с ростом температуры давление увеличивается. Это следует из того, что Уравнение Клапейрона – Клаузиуса применимо не только к переходу «жидкость – пар». Оно применимо ко всем переходам первого рода. В общем виде его можно записать так:
Используя уравнение Клапейрона – Клаузиуса можно представить диаграмму состояний системы в координатах Р,Т (рис.5.9). На этой диаграмме кривая 1 – кривая сублимации. Она соответствует равновесному состоянию двух фаз: твёрдой и парообразной. Точки, лежащие слева от этой кривой характеризуют однофазное твёрдое состояние. Точки, лежащие справа, характеризуют парообразное состояние. Кривая 2 – кривая плавления. Она соответствует равновесному состоянию двух фаз: твёрдой и жидкой. Точки, лежащие слева от этой кривой характеризуют однофазное твёрдое состояние. Точки, лежащие справа от неё до кривой 3, ха
|

 . Равновесие между фазами наступит при условии, что Т1 = Т2 и Р1=Р2. Рассмотрим бесконечно малый обратимый цикл Карно (рис.5.8), изотермы которого соответствуют состоянию двухфазной системы при температурах Т и dT. Поскольку параметры состояния при этом изменяются бесконечно мало, изотермы и адиабаты на рис.5.8 изображены прямыми. Давление в таком цикле изменяется на величину dP. Работа системы за цикл определяется формулой:
. Равновесие между фазами наступит при условии, что Т1 = Т2 и Р1=Р2. Рассмотрим бесконечно малый обратимый цикл Карно (рис.5.8), изотермы которого соответствуют состоянию двухфазной системы при температурах Т и dT. Поскольку параметры состояния при этом изменяются бесконечно мало, изотермы и адиабаты на рис.5.8 изображены прямыми. Давление в таком цикле изменяется на величину dP. Работа системы за цикл определяется формулой:  .
. , где
LП – удельная теплота парообразования,
т- масса жидкости, переведённой в пар.
, где
LП – удельная теплота парообразования,
т- масса жидкости, переведённой в пар.
 Энтропия возрастает
ΔSП >0
Энтропия возрастает
ΔSП >0
 , где
LКОН – величина удельной теплоты конденсации,
т- масса пара, переведённого в жидкость
, где
LКОН – величина удельной теплоты конденсации,
т- масса пара, переведённого в жидкость
 Энтропия убывает
ΔSкон < 0
Энтропия убывает
ΔSкон < 0
 , где
LПЛ – удельная теплота плавления,
т- масса твёрдого тела, переведённого в жидкость
, где
LПЛ – удельная теплота плавления,
т- масса твёрдого тела, переведённого в жидкость
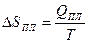 Энтропия возрастает
ΔSПЛ > 0
Энтропия возрастает
ΔSПЛ > 0
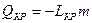 , где
LКР – величина удельной теплоты кристаллизации,
т- масса жидкости, переведённой в твёрдое тело - кристалл
, где
LКР – величина удельной теплоты кристаллизации,
т- масса жидкости, переведённой в твёрдое тело - кристалл
 Энтропия убывает
ΔSКР < 0
Энтропия убывает
ΔSКР < 0
 , где
LС – удельная теплота сублимации,
т- масса твёрдого тела, переведённого в пар
, где
LС – удельная теплота сублимации,
т- масса твёрдого тела, переведённого в пар
 Энтропия возрастает
ΔSC > 0
Энтропия возрастает
ΔSC > 0
 или
или  , где LП – удельная теплота парообразования. Приравнивая правые части этих равенств, и подставив выражение работы через давление и объём, получим:
, где LП – удельная теплота парообразования. Приравнивая правые части этих равенств, и подставив выражение работы через давление и объём, получим:  . Соотнесём изменение давления с изменением температуры и получим:
. Соотнесём изменение давления с изменением температуры и получим: (5.23)
(5.23) , а значит и
, а значит и  .
. (5.24)
(5.24) рактеризуют жидкое состояние. Кривая 3 – кривая парообразования. Она соответствует равновесному состоянию двух фаз: жидкой и парообразной. Точки, лежащие слева от этой кривой характеризуют однофазное жидкое состояние. Точки, лежащие справа, характеризуют парообразное состояние. Кривая 3, в отличии от кривых 1 и 2, ограничена с двух сторон. С одной стороны – тройной точкой Тр, с другой стороны - критической точкой К (рис.5.9). Тройная точка описывает равновесное состояние сразу трёх фаз: твёрдой, жидкой и парообразной.
рактеризуют жидкое состояние. Кривая 3 – кривая парообразования. Она соответствует равновесному состоянию двух фаз: жидкой и парообразной. Точки, лежащие слева от этой кривой характеризуют однофазное жидкое состояние. Точки, лежащие справа, характеризуют парообразное состояние. Кривая 3, в отличии от кривых 1 и 2, ограничена с двух сторон. С одной стороны – тройной точкой Тр, с другой стороны - критической точкой К (рис.5.9). Тройная точка описывает равновесное состояние сразу трёх фаз: твёрдой, жидкой и парообразной.


