Парциальные и интегральные термодинамические величины– Задача. Определить парциальную и относительную парциальную энтальпии кремния в жидком железе, а также относительную интегральную энтальпию расплавов Fe–Si по результатам калориметрических измерений. – Исходные данные. 1. Теплоты смешения Q образцов кремния заданной массы т с 300 г жидкого железа (таблица). 2. Температура образцов кремния 298 К, температура расплава 1873 К. 3. Энтальпия кремния при 1873 К: Парциальная
– Теория. Парциальная мольная энтальпия
– где Н - интегральная энтальпия раствора
– Интегральная мольная энтальпия раствора Нm определяется по формуле
– Из выражения (1.1) следует:
– где – Относительные парциальная D Нi и интегральная D Нm энтальпии равны:
– где – Относительную парциальную энтальпию называют также теплотой растворения, относительную интегральную энтальпию - теплотой образования раствора. – Решение. В калориметре при смешении образца кремния с расплавом железа измеряют тепловой эффект, включающий изменение энтальпии кремния при нагреве от 298 до 1873 К и теплоту образования раствора. Масса растворяемых образцов пренебрежимо мала по сравнению с массой растворителя - железа, поэтому измеряемая величина близка к парциальной энтальпии кремния (т.е. Q» -(¶ Н/ ¶ n Si) T , p). Мольную парциальную энтальпию кремния в растворе железа вычисляем по формуле
– где Q - измеряемый в калориметре тепловой эффект смешения образца кремния массой т с расплавом железа (теплота реакции и изменение энтальпии имеют противоположные знаки, поэтому Q имеет знак минус); М - масса моля кремния, равная 28. – Например, для первой добавки кремния (m = 0,392 г, Q = 605 Дж)
– Относительная парциальная мольная энтальпия кремния
– Для первой добавки кремния D H Si = -43,2 - 91,1 = -134,3 кДж/моль. Рассчитанные величины – Примечания. 1. Другие парциальные, относительные парциальные и интегральные мольные величины определяют аналогичным образом. Например, парциальная мольная энергия Гиббса, называемая также химическим потенциалом m i, – 2. Парциальная мольная величина характеризует изменение свойства раствора. Она может быть как положительной, так и отрицательной. – 3. Если при проведении калориметрического опыта температура растворяемого компонента i равна температуре растворителя, то измеряемая теплота представляет собой относительную парциальную энтальпию D Hi . Подогрев добавок является одним из способов повышения точности определения теплот растворения.
|

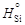 = 91,1 кДж/моль.
= 91,1 кДж/моль.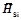 и относительная парциальная D Н Si
и относительная парциальная D Н Si 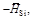 кДж/моль
кДж/моль
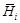 характеризует изменение энтальпии раствора при добавлении к нему бесконечно малого количества компонента i при постоянных температуре, давлении и числах молей пj других компонентов:
характеризует изменение энтальпии раствора при добавлении к нему бесконечно малого количества компонента i при постоянных температуре, давлении и числах молей пj других компонентов: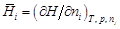 ,
,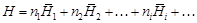 . (1.1)
. (1.1)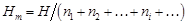 .
.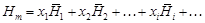 ,
,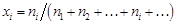 - мольная доля компонента i.
- мольная доля компонента i.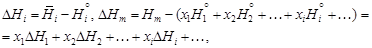
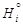 - мольная энтальпия чистого компонента i.
- мольная энтальпия чистого компонента i. ,
,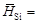 -(605×28/0,392) = -43214 Дж/моль.
-(605×28/0,392) = -43214 Дж/моль.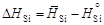 .
.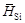 и D H Si приведены в таблице. В исследованном интервале концентраций значения
и D H Si приведены в таблице. В исследованном интервале концентраций значения 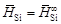 ,
, 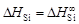 . Вычисляем относительную интегральную мольную энтальпию: D Hm = x SiD H Si + x FeD H Fe. В области разбавленных растворов D H Fe = 0, поэтому D Hm = x SiD H Si. Среднее значение D H Si составляет -134 кДж/моль, так что D Hm = -134 x Si (кДж/моль).
. Вычисляем относительную интегральную мольную энтальпию: D Hm = x SiD H Si + x FeD H Fe. В области разбавленных растворов D H Fe = 0, поэтому D Hm = x SiD H Si. Среднее значение D H Si составляет -134 кДж/моль, так что D Hm = -134 x Si (кДж/моль).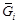 = m i = (¶ G /¶ ni) p , T, n j; парциальная мольная энтропия
= m i = (¶ G /¶ ni) p , T, n j; парциальная мольная энтропия 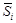 =(¶ S /¶ ni) p , T, n j; парциальный мольный объем
=(¶ S /¶ ni) p , T, n j; парциальный мольный объем 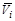 = (¶ V /¶ ni) p , T, n j.
= (¶ V /¶ ni) p , T, n j.


