Теорія адсорбції Ленгмюра
Теорія адсорбції створена Ленгмюром в 1915 р. стала фундаментальним внеском в теорію адсорбції. При розробці своєї теорії адсорбції Ленгмюр зробив наступні припущення теорії: Адсорбція відбувається лише на певних адсорбційних центрах (молекули не рухаються по поверхні адсорбенту). Кожний адсорбційний центр взаємодіє тільки з однією молекулою утворюючи мономолекулярний шар. Адсорбційні центри енергетично еквівалентні, а поверхня – еквіпотенціальна. Число адсорбційних центрів на одиницю поверхні є величина стала. Адсорбовані молекули не взаємодіють між собою. В теорії Ленгмюра адсорбція розглядається як псевдохімічна рівноважна реакція між молекулою адсорбату В і адсорбційним центром на поверхні А’ в результаті якої утворюється комплекс А’В. A’ + B = A’B Константа рівноваги цієї реакції дорівнює:
сAB = A – адсорбція (концентрація адсорбату на поверхні адсорбенту). с = сB - концентрація адсорбату в об’ємі системи. сA =A0 = A∞ - A число вільних адсорбційних центрів. A∞ - гранична адсорбція (ємність моношару).
Якщо виразити з цього рівняння адсорбцію одержуємо рівняння ізотерми адсорбції Ленгмюра:
Так як концентрація газів пропорційна парціальним тискам то ізотерма адсорбції Ленгмюра виражена через тиск має наступний вигляд:
Графічно залежність адсорбції від тиску або концентрації представлена на (рис.21). Цю залежність можна умовно розділити на три області. Проаналізуємо граничні області ізотерми адсорбції: І область: с → 0, Кс <<1, A = A∞Kс = КГс тобто на цій ділянці рівняння Ленгмюра перетворюється на рівняння Генрі. ІІІ область: с → ∞, A ≈ A∞, тобто поверхня адсорбату повністю заповнена молекулами адсорбенту.
Рис. 21. Ізотерма адсорбції Ленгмюра.
Для розрахунку параметрів рівняння Ленгмюра його зручно використовувати в лінійній формі:
Якщо побудувати ізотерму адсорбції в координатах 1/А=f(1/с) то одержимо пряму лінію, яка відтинає на осі ординат відрізок рівний 1/А∞ з тангенсом кута нахилу
За значенням А∞ можна розрахувати питому поверхню адсорбенту: Sпит = A∞NАSо, де (4.40) Sо – площа, яку займає одна молекула в поверхневому шарі.
Рис. 22. Визначення констант рівняння Ленгмюра.
Ізотерма адсорбції Ленгмюра добре описує адсорбцію на однорідній поверхні в мономолекулярному шарі при будь-яких значеннях тиску і концентрації. Область ІІ (рис.21) можна також описати емпіричним рівнянням адсорбції Фрейндліха A = KFс1/n , або A = KFр1/n (4.41) В лінійній формі рівняння Фрейндліха має вигляд: ln A = ln KF +1/n∙lnс (4.42) На (рис.23) наведено графічний метод визначення констант рівняння Фрейндліха.
Рис. 23. Визначення констант рівняння Фрейндліха.
При адсорбції газів з їх суміші величини їх адсорбцій додаються, а вільних адсорбційні центри є спільними для багатокомпонентної системи. Константи рівноваги адсорбції кожного з газів можна записати, як:
Величина адсорбції для компонента суміші дорівнює:
Aі = A0Kіpі (4.44)
При адсорбції з суміші газів кожний з компонентів адсорбується завжди в меншій кількості, ніж при адсорбції одного з цих газів. При цьому, чим краще адсорбується газ, тим краще відбувається його адсорбція з суміші. В деяких випадках адсорбція одного з компонентів може бути настільки значною, що адсорбція інших компонентів практично не відбувається. Наприклад при адсорбції парів органічних речовин на активованому вугіллі, вплив компонентів повітря на адсорбцію практично відсутній.
Приклад 4.1 При дослідженні адсорбції парів води макропористим силікагелем при кімнатній температурі отримана ізотерма адсорбції. При представленні її у вигляді (1/А) = f(1/р) - одержали пряму лінію, яка відсікає на осі ординат відрізок b = 0,35 кг/моль, а тангенс кута нахилу прямої становить tg α = 0,00575(кг∙Па/моль). Запишіть рівняння дослідженої ізотерми і розрахуйте його константи. Досліджена ізотерма адсорбції Ленгмюра, яка в лінійній формі має вигляд:
(1/А∞)= 0,35(кг/моль), А∞=2,9(моль/кг); Константи ізотерми адсорбції Ленгмюра дорівнюють: tg α = (1/А∞К)=0,00575(кг∙Па/моль); К= 61 Па-1 Приклад 4.2 При дослідженні адсорбції діоксиду вуглецю на активованому вугіллі при 293К отримали прямолінійну залежність ln A = f (ln p), яка відсікає відрізок на осі ординат b = 8,80, а тангенс кута нахилу прямої становить tg α = -0,45. Запишіть рівняння ізотерми адсорбції і визначить його константи. Досліджена ізотерма описується емпіричним рівнянням Фрейндліха A = KFp1/n; ln A = ln KF +1/n ∙ln p, Константи рівняння Фрейндліха дорівнюють: ln КF=8,8; КF = 6634; (1/n)= -0,45; n = -2,2.
|

 (4.35)
(4.35) (4.36)
(4.36)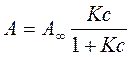 (4.37)
(4.37) (4.38)
(4.38)
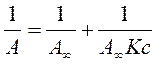 (4.39)
(4.39)


 ;
;  ;...;
;...;  (4.43)
(4.43) (4.45)
(4.45) ;
;


