Способы выражения состава растворов. Коллигативные свойства растворов
Концентрация раствора – это относительное содержание растворенного вещества в растворе. Рассмотрим некоторые способы выражения концентрации раствора. − Массовая доля вещества w(Х) Это безразмерная величина, равная отношению массы растворенного вещества m(X) к общей массе раствора m(р-ра): w(Х)= Часто массовую долю выражают в процентах и называют процентной концентрацией по массе: w %(Х)= Массовую долю также можно выражать в промилле (0/00) – это 0,1%; в ррm – это 10-4% и в ррв – это 10-7% (одна часть на миллиард). Массовая доля вещества, выраженная в процентах, показывает, сколько граммов данного вещества содержится в 100 граммах раствора. − Молярная концентрация вещества или молярность Обозначается С(Х). Это отношение количества растворенного вещества n(Х), выраженного в моль, к объему раствора V, выраженному в литрах:
Молярная концентрация выражается в моль/л. В литературе часто встречаются сокращенные обозначения, например запись «1 М раствор» означает раствор, имеющий концентрацию 1 моль/л, его еще называют одномолярным раствором. − Молярная концентрация вещества эквивалента Обозначается С(1/z X). Эту концентрацию еще называют эквивалентной концентрацией, нормальной концентрацией или нормальностью. Она представляет собой отношение количества вещества эквивалента n(1/z Х), выраженного в моль, к объему раствора V, выраженного в литрах:
Данная концентрация выражается в моль/л, иногда, чтобы подчеркнуть отличие от молярной концентрации, записывают моль экв./л. Возможны также сокращения, например запись «1н. раствор» означает раствор, в одном литре которого содержится 1 моль вещества эквивалента, такой раствор называют однонормальным. Так как вещества взаимодействуют друг с другом в эквивалентных количествах, то для двух растворов взаимодействующих веществ выполняется равенство V(X1) × C(1/z1 X1)= V(X2) × C(1/z2 X2) (2.4.5) Следовательно, растворы равной нормальности реагируют в равных объемах. − Моляльная концентрация (моляльность) Обозначается b(Х). Это отношение количества растворенного вещества n(Х), выраженного в моль, к массе растворителя m, выраженной в килограммах:
Данная концентрация выражается в моль/кг. − Титр Обозначается Т(Х). Это масса растворенного вещества в граммах, содержащаяся в одном миллилитре раствора: Т(Х)=m(X):V. (2.4.7) Титр выражается в г/мл (г/см3). − Молярная доля (мольная доля) Обозначается
Может быть безразмерной величиной или выражаться в процентах. − Объемная доля Обозначается j(Х). Представляет собой отношение объема данного компонента системы к общему объему системы: j (Х) =V (X): V. (2.4.9) Может быть безразмерной величиной или выражаться в процентах. Для перехода от массы раствора к его объему и наоборот нужно знать величину плотности r: r=m: V. (2.4.10) Плотность выражается в г/см3 (г/мл), кг/м3, г/л, и в других единицах. Свойства растворов, которые зависят от числа частиц растворенного вещества и от количества растворителя, но практически не зависят от природы растворенного вещества, называются коллигативными. К таким свойствам относятся: понижение давления насыщенного пара растворителя над раствором, понижение температуры замерзания (кристаллизации) раствора, повышение температуры кипения раствора по сравнению с чистым растворителем, осмос. Коллигативные свойства растворов могут проявляться в полной мере лишь в идеальных растворах, в которых нет химического взаимодействия между компонентами, а силы межмолекулярного взаимодействия между частицами растворителя, с одной стороны, и частицами растворенного вещества, с другой стороны, одинаковы. Образование таких растворов не сопровождается тепловым эффектом, и каждый компонент ведет себя независимо от других. Разбавленные растворы нелетучих неэлектролитов приближаются по своим свойствам к идеальным растворам. Для них можно использовать количественные закономерности, полученные для идеальных растворов. Ниже приводятся аналитические выражения для этих закономерностей.
|

 . (2.4.1)
. (2.4.1) . (2.4.3)
. (2.4.3) . (2.4.4)
. (2.4.4) . (2.4.6)
. (2.4.6)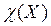 . Представляет собой отношение количества вещества данного компонента, выраженного в моль, к суммарному количеству всех веществ, входящих в состав раствора, включая растворитель:
. Представляет собой отношение количества вещества данного компонента, выраженного в моль, к суммарному количеству всех веществ, входящих в состав раствора, включая растворитель: . (2.4.8)
. (2.4.8)


