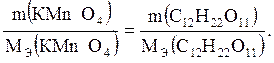Фактор эквивалентности вещества Х, участвующего в ионообменном процессе, равенfэ (Х) = 1: (Ni·|zi|), где Ni и zi - соответственно число и заряд ионов, которыми обменивается молекула реагирующего вещества со своим партнером. Многоосновные кислоты НnА и многокислотные основания М(ОН)n имеют по n факторов эквивалентности: от 1 до 1/ n. Если факторы эквивалентности соляной кислоты HCl и гидроксида натрия NаОН в обменных процессах всегда равны 1, то у серной кислоты Н2SО4 и гидроксида кальция Са(ОН)2 факторы эквивалентности равны 1 и 1/2, а у ортофосфорной кислоты Н3РО4 и гидроксида алюминия Аl(ОН)3 – 1, 1/2, 1/3. Для солей фактор эквивалентности может быть найден по числу замещенных катионов или анионов. Для солеобразующих оксидов фактор эквивалентности определяется числом катионов соответствующего оксиду основания или анионов соответствующей оксиду кислоты и их зарядом. В реакции между оксидом фосфора (V) и оксидом кальция Р2О5 + СаО → Са3(РО4)2 фактор эквивалентности Р2О5, образующего два трехзарядных фосфат-иона (РО43-) равен 1/6, а для СаО, образующего один двухзарядный катион (Са2+), 1/2. В некоторых реакциях молекулы одного вещества претерпевают разные превращения, например, одна часть молекул участвует в окислительно-восстановительном процессе, а другая часть молекул того же вещества – в процессе ионного обмена. Для такой реакции следует находить общий фактор эквивалентности, как сумму факторов эквивалентности, учитывающих каждое превращение данного вещества. Пример 3. В нижеприведенных схемах реакций определите факторы эквивалентности исходных веществ: а) LiOH + H3PO4 → Li2HPO4 + H2O Молекула LiOH теряет в данной реакции один однозарядный ион ОН- , поэтому fэ (LiOH) = 1: (1·|-1|) = 1; молекула H3PO4 обменивается двумя однозарядными ионами Н+ , поэтому fэ (H3PO4) = 1: (2·|+1|) = 1: 2. б) Al2(SO4)3 +ВаCl2 → Ва SO4 + AlCl3 Величина fэ(Al2(SO4)3) может быть рассчитана либо по числу ионов алюминия, замещенных ионами бария, либо по числу сульфат-ионов, образующих с ионами бария осадок. И в том, и в другом случае результат одинаков: fэ(Al2(SO4)3) = 1: (2·|+3|) = 1: (3·|-2|) = 1: 6. Величина fэ(ВаCl2)может быть рассчитана либо по числу ионов бария, замещенных ионами алюминия, либо по числу хлорид-ионов, образующих с ионами алюминия растворимую соль. fэ (ВаCl2)= 1: (1·|+2|) = 1: (2·|-1|) = 1: 2. в) ZnО + СО2 → ZnСО3 Величина fэ (ZnО), образующего один двухзарядный ион Zn 2+, равен 1/2; fэ (СО2), образующего один двухзарядный ион (СО32-), равна 1/2. г ) Zn + Н2SO4 (конц.) → Н2S + Zn SO4 + Н2О Превращаясь вН2S-2, молекула Н2S+6 O4 присоединяет 8 электронов, т.е. fэ = 1/8; а образуя Zn SO4, молекула Н2SO4 теряет два иона Н+, т.е. fэ = 1/2. Общий фактор эквивалентности fэ(Н2SO4) = 1/8 + 1/2 = 5/8. Пример 4. Выразить эквивалентную массу оксида, гидроксида, сульфата и хлорида металла. Решение. Эквивалентная массавещества в общем случае определяется по формуле (1.1). В частном случае ее можно представить как сумму эквивалентных масс составных частей молекулы или кристалла вещества. 1. Молекула или кристалл оксида любого элемента образованы атомами данного элемента и кислорода. Таким образом, эквивалентная масса оксида равна сумме эквивалентных масс элемента и кислорода:
Согласно формуле (1.1) Мэ(О) = fэ (О)·М(О) = 16: 2 = 8 г/моль.
Следовательно,
2. В состав гидроксида входят атомы металла и гидроксильные группы:
Согласно формуле (1.1)
Мэ(ОН-) = fэ (ОН-)·М(ОН-) = 17: 1 = 17 г/моль.
Таким образом,
3. В молекулу сульфата металла входят ионы данного металла и сульфатные группы (SO4)2-:
Согласно формуле (1.1)
Мэ(SO4 2-) = fэ (SO4 2-)·М(SO4 2-) = 96: 2 = 48 г/моль.
Таким образом,
4. Эквивалентную массу хлорида металла определяют по аналогии с предыдущими случаями:
Мэ(Cl-) = fэ (Cl-)·М(Cl-) = 35, 5: 1 = 35, 5 г/моль
Закон эквивалентов. Массы (объемы) реагирующих друг с другом или образующихся в результате реакции веществ пропорциональны их эквивалентным массам Мэ (эквивалентным объемам для газов Vэ):
m1: Мэ1 = m2: Мэ2 = V1: Vэ1= V2: Vэ2. Пример 5. Оксид марганца содержит 22, 56% кислорода. Найти эквивалентную массу и валентность марганца в этом соединении. Составить формулу оксида. Решение. Пусть масса оксида марганца равна 100 г, тогда масса кислорода будет составлять 22, 56 г. На основании закона эквивалентов можно составить следующую пропорцию:
Примем Мэ(Мn) = А г/моль, тогда, согласно формулы (1.2),
Решая уравнение относительно А, получим А = 27, 5 г/моль. Валентность марганца (по модулю совпадающую со степенью окисления) определим по формуле, связывающей молярную и эквивалентную массы элемента (1.1),
Мэ(Mn) = fэ (Mn )·М(Mn ) = М(Mn ): В (Mn ), откуда
Так как в оксидах кислород двухвалентен, получаем следующую формулу оксида марганца: MnO. Пример 6. Рассчитать массу сахарозы С12Н22О11, если на ее окисление до углекислого газа СО2 в присутствии серной кислоты израсходовано 100 г перманганата калия КМnО4 (в кислой среде образуется МnSО4). Решение. В данной реакции степень окисления марганца изменяется от +7 (КМnО4) до +2 (МnSО4), а углерода – от 0 (С12Н22О11) до +4 (СО2). Следовательно, для перманганата калия fэ = 1/5, а для сахарозы 1/48, так как в ее молекулу входят 12 атомов углерода. Тогда Мэ (КМnО4) = 158: 5 = 31, 6 г/моль, и Мэ(С12Н22О11) =342: 48 =7, 1 г/моль. Согласно закону эквивалентов
Тогда m(С12Н22О11) = m(КМnО4)·7, 1/31, 6 =710/31, 6=22, 45 г. Газовые законы. Параметры состояния, единицы измерения: V – объем, м3; Р – давление, Па; Т – температура, К; m – масса газа, кг; М – молярная масса газа, кг/моль; Мэ – молярная масса эквивалента газа, кг/моль; R – универсальная газовая постоянная, R = 8, 314 Дж/(моль·К). Нормальные условия (н.у.): 273, 15 К(0 °С); 1, 0133·105 Па (760 мм рт.ст.). Объединенный газовый закон: р·V/Т = const. Уравнение Клапейрона - Менделеева: р·V = m RТ/М.
Закон Авогадро: В равных объемах любых газов при одинаковых условиях (температура и давление) содержится одинаковое число соответствующих структурных единиц (молекул или атомов).
|



 (1.2)
(1.2)

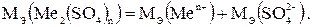



 (1.3)
(1.3) . Исходя из формулы (1.1),
. Исходя из формулы (1.1),  . Подставляя полученные значения в формулу (1.3), имеем
. Подставляя полученные значения в формулу (1.3), имеем .
.