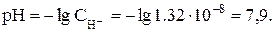Примеры решения типовых задач. Пример 1.Напишите выражение константы гидролиза КГ для процесса гидролиза цианида натрия
Пример 1. Напишите выражение константы гидролиза КГ для процесса гидролиза цианида натрия. Уравнение гидролиза этой соли имеет вид: NaCN + HOH «HCN + NaOH.
Выражение константы гидролиза Кг: КГ = Пример 2. Рассчитайте константу гидролиза хлорида аммония. Константа диссоциации NH4OH равна Кд =77× 10-5 . Уравнение гидролиза хлорида аммония: NH4Cl + HOH «NH4OH + HCl. Решение. Константа гидролиза соли может быть вычислена по формулам
где КГ – константа гидролиза соли;
В данной задаче используем формулу (15) и вычисляем константу гидролиза NH4CI:
Пример 3. Найдите степень гидролиза 0, 01 н раствора ацетата калия и рН этого раствора. Константа диссоциации CH3COOH равна 1, 75× 10-5. Решение. Степень и константа гидролиза связаны между собой соотношением
где С – концентрация соли, моль/л; h – степень гидролиза соли. Обычно степень гидролиза соли значительно меньше единицы, поэтому приведенное выражение можно упростить:
Если константу гидролиза выразить через отношение (16), приведенное в примере 2, то получим выражение
Отсюда степень гидролиза соли
Для 0, 001 н раствора ацетата калия степень гидролиза равна: Уравнение реакции гидролиза ацетата калия:
KСН3СОО + НОН «СН3СООH + КОН.
Применив закон действующих масс к этой реакции, получим:
К= Величину
Концентрация образовавшейся при гидролизе СН3СООH равна концентрации ионов ОН-, тогда
Используя это выражение, можно определить рН раствора:
Контрольные вопросы и задачи для самостоятельной работы
1. Какой процесс называется гидролизом соли? 2. Все ли соли подвергаются гидролизу? 3. Как влияют нагревание и разбавление раствора на гидролиз солей? Почему? 4. Что называется константой гидролиза соли? 5. Какая из приведенных солей подвергается гидролизу с образованием кислой соли: а) нитрат аммония; б) сульфид натрия; в) хлорид аммония; г) сульфат меди? 6. Какая из приведенных солей подвергается гидролизу с образованием основной соли: а) бромид натрия; б) сульфид аммония; в) хлорид меди; г) ацетат натрия? 7. Какая из приведенных солей подвергается гидролизу с образованием основной соли: a) Na3PO4; б) KI; в) LiCl; г) ВiCl3? 8. Какая из приведенных солей подвергается гидролизу с образованием основной соли: a) Na2НPO4; б) KСN; в) (NH4)2CО3; г) KCN? 9. В каком из водных растворов приведенных ниже веществ рН > 7: а) карбонат натрия; б) сульфат меди; в) нитрат висмута; г) хлорид алюминия? 10. В каком из водных растворов приведенных веществ рН > 7: а) ацетат натрия; б) сульфат железа; в) нитрат меди; г) хлорид хрома? 11. В каком из водных растворов приведенных ниже веществ рН > 7: а) сульфид калия; б) сульфат меди; в) хлорид алюминия; г) хлорид калия? 12. В каком из водных растворов приведенных ниже веществ рН < 7: a) K3PO4; б) K2SO4; в) Li2S; г) CuSO4? 13. В каком из водных растворов приведенных ниже веществ рН < 7: a) Bi(NO3)2; б) Na2SO4; в) LiCl; г) K2CO3? 14. В растворе какой из солей лакмус окрашивается в красный цвет: a) KNO3; б) CH3COONa; в) СuCl2; г) K2CO3? 15. В растворе какой из солей лакмус окрашивается в cиний цвет: a) NH4NO3; б) Na2S; в) FeCl3; г) K2SO4? 16. Какая из приведенных солей подвергается гидролизу с образованием основной соли: a) NaNO3; б) Сu(NO3)2; в) CH3COONH4; г) KCNS? 17.Какая из приведенных солей подвергается гидролизу с образованием основной соли: a) Na2НPO4; б) KСN; в) (NH4)2CО3; г) Al2(SO4)3? 18. Какая из данных солей подвергается гидролизу в водном растворе: а) нитрат калия; б) сульфат калия; в) сульфат меди; г) хлорид натрия? 19. Какая из приведенных солей подвергается гидролизу с образованием кислой соли: а) сульфат натрия; б) хлорид алюминия; в) нитрат висмута; г) фосфат калия? 20. Какая из приведенных солей подвергается гидролизу с образованием кислой соли: а) сульфат железа; б) хлорид хрома; в) карбонат калия; г) сульфат меди? 21. Какая из приведенных солей подвергается гидролизу с образованием кислой соли: а) сульфат алюминия; б) хлорид цинка; в) карбонат натрия; г) нитрат магния? 22. Какая из приведенных солей не подвергается гидролизу в водном растворе: а) фосфат калия; б) хлорид железа; в) карбонат калия; г) нитрат натрия? 23. Какая из приведенных солей не подвергается гидролизу в водном растворе: а) сульфат калия; б) хлорид цинка; в) карбонат натрия; г) нитрат аммония? 24. Усиление или подавление гидролиза цианида натрия вызовет прибавление к раствору: а) кислоты; б) щелочи; в) хлорида аммония? 25. Вычислите рН и степень гидролиза 0, 1н раствора NH4Сl. 26. Вычислите константу гидролиза Кг, степень гидролиза h, рН при комнатной температуре в растворах солей, гидролизующихся по аниону слабой одноосновной кислоты: а) в 0, 1 М СН3СООNa; б) в 0, 01 М KСN; в) 0, 1 М KСN. 27. Вычислите константу гидролиза Кг, степень гидролиза h, рН при комнатной температуре в растворах солей, подвергающихся гидролизу по катиону с однокислотного основания: а) в 0, 1 М растворе нитрата аммония; б) в 0, 01 М растворе хлорида аммония; в) в 0, 01 М растворе нитрата аммония. 28. Вычислите константу гидролиза Кг, степень гидролиза h, рН при комнатной температуре в растворах солей, образованных слабой кислотой и слабым основанием: а) в 0, 1 М растворе ацетата аммония; б) в 0, 1 М растворе NH4СN. 29. Вычислите константу гидролиза Кг, степень гидролиза h, рН при комнатной температуре в растворах солей слабых многоосновных кислот или слабых оснований, считая, что гидролиз идет практически лишь по первой ступени: а) в 0, 1 М растворе Cd(NO3)2; б) в 1 М растворе AlСl3; в) 0, 01 М растворе Na2CO3. 30. Вычислите константу гидролиза., степень гидролиза и рН при комнатной температуре в растворах солей, образованных слабой кислотой и слабым основанием: а) в 0, 1 М растворе NH4CH3COO; б) в 0, 1 М растворе NH4CN. 31. По значению рН вычислите молярную концентрацию, константу и степень гидролиза соли в следующих растворах: а) NH4Cl, pH=5, 62; б) NH4NO3, pH=6, 12; в) NaCH3COO, pH=8, 36; г) KCN, pH=11, 57.
|


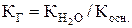 (15)
(15) (16)
(16) (17)
(17) - ионное произведение воды;
- ионное произведение воды;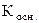 – константа диссоциации слабого однокислотного основания;
– константа диссоциации слабого однокислотного основания;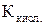 – константа диссоциации слабой одноосновной кислоты.
– константа диссоциации слабой одноосновной кислоты.




 .
. .
.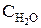 в разбавленных растворах можно считать величиной постоянной. Обозначив произведение через
в разбавленных растворах можно считать величиной постоянной. Обозначив произведение через  = K× [HOH], имеем
= K× [HOH], имеем .
.
 =
=  (моль/л);
(моль/л);