Основные теоретические положения. Раствор – однофазная гомогенная система, состоящая из двух или более компонентов, а также продуктов их взаимодействияРаствор – однофазная гомогенная система, состоящая из двух или более компонентов, а также продуктов их взаимодействия, состав которой может непрерывно меняться в пределах, ограниченных взаимной растворимостью веществ. Важнейшей характеристикой раствора является количественное содержание растворенных в нем веществ. Состав раствора принято выражать с помощью следующих величин: 1. Массовая доля растворенного вещества w2 (иначе процентная массовая концентрация) – отношение массы растворенного вещества m 2 к массе раствора m:
Здесь и далее у величин, относящихся к растворителю, применяется индекс «1», индекс «2» относится к растворенному веществу, а отсутствие индекса указывает на свойство раствора как целого. ω 2 – безразмерная величина, выраженная в долях единицы или в процентах, % мас. 2. Моляльная концентрация вещества Сm (иначе моляльность раствора) – отношение числа моль растворенного вещества n 2 к массе растворителя m 1 в килограммах:
где М 2 – молярная масса растворенного вещества, г/моль. Если массу растворителя выражать в граммах, то для расчета моляльности следует пользоваться формулой
3. Молярная концентрация вещества С 2 (иначе молярность раствора) – отношение числа моль растворенного вещества к объему раствора V в дм3 (иначе в литрах)
Она показывает, сколько моль растворенного вещества содержится в 1 дм3 или 1 л раствора. Единицы молярной концентрации – моль/дм3 или М. 4. Молярная концентрация эквивалента вещества С э (иначе нормальность раствора, нормальная концентрация или эквивалентная концентрация) – отношение числа моль эквивалентов растворенного вещества n 2
где М 2 Нормальность раствора показывает, сколько моль эквивалентов растворенного вещества содержится в 1 дм3 раствора. Единицы нормальности раствора – моль/дм3 или н. Взаимосвязь между молярной и нормальной концентрациями одного и того же растворенного вещества выражается соотношением
То есть эквивалентная концентрация в z раз больше молярной концентрации. 5. Титр раствора Т – масса растворенного вещества в граммах, которая содержится в 1 см3 (иначе 1 мл) раствора:
Единицы измерения данного способа выражения состава раствора – г/мл или г/см3. 6. Мольная доля растворенного вещества х 2 – отношение числа моль растворенного вещества к общему числу моль всех компонентов раствора n:
Это безразмерная величина, выраженная в долях единицы. Если при сливании двух растворов, содержащих различные по природе растворенные вещества, между ними происходит химическое взаимодействие, то по закону эквивалентов вещества реагируют в количествах, пропорциональных их эквивалентам. Например, для процесса взаимодействия кислоты с основанием будет выполняться соотношение
На использовании данного закона основана совокупность методов количественного анализа, называемая титриметрия. В основе титриметрического анализа лежит процесс титрования, который заключается в измерении объемов растворов вступающих в реакцию веществ. Зная объемы растворов и концентрацию одного из них, можно рассчитать концентрацию другого раствора по формуле (1). Процесс титрования обычно проводят следующим образом: в бюретку наливают раствор какого-либо вещества с известной концентрацией. Этот реагент называется титрантом. Пипеткой отбирают точный объем раствора вещества (иначе аликвотную часть), концентрацию которого нужно определить. Аликвотную часть анализируемого раствора переносят в коническую колбу и по каплям приливают титрант из бюретки, непрерывно перемешивая раствор. Момент, когда анализируемое вещество прореагировало со строго эквивалентным количеством титранта, называется точкой эквивалентности. Окончание реакции (точка эквивалентности) фиксируется либо визуально (например, по изменению окраски индикатора), либо путем измерения какого-либо физико-химического свойства системы (оптическая плотность, рН, электропроводимость, ЭДС и др.), при этом взаимодействие титранта с анализируемым веществом должно протекать практически полностью, с высокой скоростью и без побочных процессов. Достаточно часто в аналитической практике применяют метод прямого кислотно-основного титрования, в основе которого лежит реакция нейтрализации. В этом случае точку эквивалентности определяют с помощью индикатора – вещества, изменяющего окраску при изменении рН раствора. Некоторые индикаторы кислотно-основного титрования и их основные характеристики приведены в табл. 1. Таблица 1
|

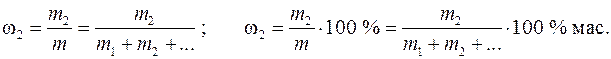
 ,
, .
.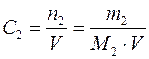 .
. к объему раствора (в дм3):
к объему раствора (в дм3): ,
,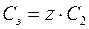 .
. .
. .
. . (1)
. (1)


