Краткая химическая характеристика s-элементовХимические элементы, в атомах которых последним заполняется электронами s -подуровень, называются s -элементами. Так как на На внешнем электронном уровне s -элементов имеется один Ионы s -элементов могут образовывать в растворах мало устойчивые комплексные соединения с органическими и неорганическими лигандами. С увеличением заряда и уменьшением радиуса катиона устойчивость комплексов увеличивается. Таким образом, комплексообразующая способность s -элементов низкая, так как: а) катионы металлов имеют завершенную электронную оболочку предыдущих инертных газов, следовательно, вакантные электронные орбитали отсутствуют и роль этих катионов, как акцепторов электронных пар лигандов, затруднена; б) согласно теории Пирсона малополяризуемые катионы Na+ и K+ являются «жёсткими» кислотами, поэтому в физиологических растворах практически не образуют устойчивых комплексов с биосубстратами, содержащими мягкие легкополяризуемые группы –СОО–, –NH2 и –SH. Относительно устойчивые комплексные соединения они образуют практически только с макроциклическими лигандами. Устойчивость образующихся комплексных соединений зависит от соотношения ионного радиуса и диаметра внутренней полости. Правильный подбор макроциклических лигандов позволяет проводить селективное связывание либо Na+, либо K+. Например, имеющийся в организме валиномицин связывает ионы K+ в 20 раз прочнее, чем Na+, так как молекула валиномицина не допускает достаточного сближения лигандов вокруг имеющего меньший радиус иона Na+. Множество алкильных групп на поверхности молекулы валиномицина обеспечивают ему гидрофобный (липофильный) характер, за счет чего он может легко переходить через мембраны клеток, перенося ионы K+ против градиента концентраций. Менее «жёсткие» s -элементы IIА-группы, в частности, Mg+2 и Cа+2, более склонны к комплексообразованию. Так, например, Са+2 образует хелатные комплексы с ЭДТА, используемые в качестве антидотов, а комплексы Mg+2 с порфирином являются основой хлорофилла. В физиологических средах катионы Mg+2 и Cа+2 встречаются как в ионизированном виде, так и в виде комплексов с белками и нуклеиновыми кислотами. Изменение Ri оказывает большое влияние на свойства его соединений: гидроксиды s -элементов обладают выраженными основными свойствами (кроме Ве(ОН)2), что объясняется непрочностью ионной связи По периоду слева направо Ri уменьшается, основные свойства и растворимость гидроксидов уменьшаются; по группе сверху вниз Ri увеличивается, основные свойства и растворимость гидроксидов увеличиваются. Большинство солей, образованных катионами ns 1-элементов, хорошо растворимы в воде, образуют осадки только с большими, легко поляризующимися анионами, например, ураты Na2C2H2N4O3×H2O. Эти соли откладываются при подагре на костях стопы. Катионы ns 2-элементов обладают высокой поляризующей способностью, что обуславливает наличие большего, в сравнении с ns 1-элементами, количества малорастворимых соединений (с анионами Соли s-элементов подвергаются гидролизу: а) соль образована сильным основанием (щелочные и щелочно-земельные металлы) и слабой кислотой: I ступень: Na2CO3 + HOH NaHCO3 + NaOH
II ступень: NaHCO3 + HOH H2CO3 + NaOH
В обычных условиях гидролиз практически ограничивается I ступенью, т.к. ионы б) с уменьшением силы основания s -элементов увеличивается способность катиона вступать в протолитическое взаимодействие с молекулами воды. Так, соли магния способны гидролизоваться по катиону с образованием основной соли. Гидролиз протекает, главным образом, по первой ступени: I ступень: MgCl2 + HOH MgOHCl + HCl Mg2+ + HOH MgOH+ + H+ pH < 7 Ионы s -элементов устойчивы к действию окислителей и восстановителей, окислительно-восстановительные реакции (ОВР) для них не характерны. В природе (земной коре) s -элементы – металлы встречаются только в виде химических соединений. Широко распространены Na, K, Mg, Ca. Остальные элементы являются редкими и рассеянными. Элементы IA-группы находятся в природе преимущественно в виде растворимых солей (в воде рек, морей, океанов) и твердых залежах. Элементы IIA-группы (кроме магния) – преимущественно в виде нерастворимых соединений: карбонаты, сульфаты, фториды. Распространенные в природе s -элементы являются одновременно и биогенными.
|

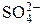 ;
; 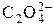 ;
; 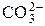 ;
; 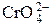 и др.) Растворимость осадков солей ns 2-элементов уменьшается с увеличением радиуса катиона.
и др.) Растворимость осадков солей ns 2-элементов уменьшается с увеличением радиуса катиона.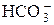 + OH– рН > 7
+ OH– рН > 7


