Современные представления о природе химической связи и строении молекулИзолированные атомы в природе встречаются очень редко. Чаще всего атомы реагируют между собой, образуя молекулу. Молекула — это физически устойчивая система из определенного числа ядер и электронов. Химическая связь имеет электрическую природу, обусловленную электростатическим взаимодействием между электронами и положительно заряженными ядрами. Химическая связь — это ядерно-электронное взаимодействие в системе, состоящей из ядер и электронов, которое приводит к минимуму энергии в этой системе. Метод валентных связей (МВС) Метод валентных связей впервые был использован в 1927 г. немецкими учеными В. Гайтлером и Ф. Лондоном для квантово-механического расчета молекулы водорода. Основные положения. 1. Химическая связь образуется за счет возникновения общих электронных пар. Одинарная связь образована одной парой электронов; двойная связь образована двумя парами электронов. Необходимо иметь в виду, что образование электронных пар — это не причина образования химической связи, а условие ее образования. Причина образования химической связи — это ядерно-электронное взаимодействие. Кратность связи по МВС определяется числом общих электронных пар. 2. В образовании общих электронных пар участвуют только электроны с антипараллельными спинами. 3. При образовании химической связи происходит перекрывание атомных орбиталей (АО) и в межъядерной области наблюдается увеличение электронной плотности. 4. Если электронные облака перекрываются по линии, соединяющей центры атомов, то это δ-связь, если вне линии — то это π-связь.
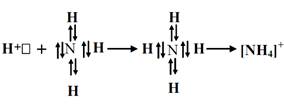
5. Единицей валентности в МВС служит общая электронная пара. Валентность элемента равна числу неспаренных электронов или числу общих электронных пар. Однако, общие электронные пары образуются и по донорно-акцепторному механизму.
В образовании химической связи может участвовать АО (вакантная) или заполненная наполовину (содержит один или два электрона). Число АО, которые участвуют в образовании химической связи, определяют максимальную валентность. Ковалентная связь возникает за счет образования электронных пар. Различают полярную и неполярную ковалентную связь. Ковалентная полярная связь образуется между атомами с различной электроотрицательностью (ЭО), при этом электронная плотность смещается в сторону наиболее электроотрицательного элемента (НCl, HBr, H2O и т. д.). При образовании неполярной ковалентной связи электронная плотность в межъядерном пространстве не сдвинута ни к одному из атомов (F2, H2, Cl2 и т. д.). Ковалентная связь характеризуется: насыщаемостью, направленностью и полярностью. Насыщаемость — это способность данного элемента образовывать ограниченное число связей с другими элементами. Направленность ковалентной химической связи. Химическая связь возникает в том направлении, при котором достигается максимальное перекрывание АО, приводящее к минимуму полной энергии системы. Угол, образованный между направлениями двух связей, носит название валентного угла. Геометрия молекул. Для объяснения пространственного строения молекул в МВС используется концепция гибридизации АО. Гибридизация АО — это не явление, а всего лишь полезный прием, с помощью которого мы можем облегчить себе задачу наглядно представить особенности строения той или иной молекулы. Содержание этого понятия сводится к тому, что в образовании химических связей участвуют не только исходные s-, р-, d-орбитали, но и гибридные АО, которые образуются из исходных АО. Под гибридизацией следует понимать такую комбинацию АО различной формы и энергии, при которой образуются гибридные АО одинаковой формы и энергии. sp1-Гибридизация. Линейная комбинация 1s-орбитали и 1р-орбитали ведет к образованию двух sр-гибридных АО.
Два гибридных sр1-облака в результате взаимного отталкивания располагаются относительно ядра атома под углом 180º. В результате такого расположения гибридных облаков молекулы состава АВ2 имеют линейную конфигурацию. sp2-Гибридизация. Это гибридизация одной s-орбитали и двух р-орбиталей. В результате комбинации трех исходных орбиталей возникают три гибридные sp2-орбитали. Они располагаются в одной плоскости под углом 120º друг к другу. Происходит выравнивание электронных облаков.
sp3-Гибридизация. Образуется в результате линейной комбинации одной s-орбитали и трех р-орбиталей. Четыре sр3-гибридные орбитали располагаются под углом 109º28ʹ друг к другу. Они направлены к вершине тетраэдра, в центре которого находится ядро атома углерода.
Поляризуемость ковалентной связи. Явление смещения электронной плотности в электрическом или магнитном поле называется поляризуемостью. Если молекулу А:В поместим в электрическое поле, то происходит смещение электронной плотности или даже разрыв химической связи. Смещение электронной плотности приводит к несовпадению центров положительных и отрицательных зарядов, молекула поляризуется и принимает характер диполя. Диполь представляет собой электрически нейтральную систему с двумя одинаковыми по величине положительными и отрицательными зарядами, находящимися на определенном расстоянии (длина диполя) друг от друга. Водородная связь Химическая связь осуществляется между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом другой молекулы: Водородная связь обозначается тремя точками. Если водородная связь образуется между разными молекулами, то она называется межмолекулярной, если связь образуется между двумя группами атомов одной и той же молекулы, то она называется внутримолекулярной. Образование межмолекулярных водородных связей приводит к изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур плавления и кипения. Ионная связь. Связь такого типа осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов. Ионы могут быть простыми, т. е. состоящими из одного атома, или сложными, т. е. состоящими из двух или более атомов. В отличие от ковалентной связи, ионная связь не обладает направленностью, Это объясняется тем, что электрическое поле иона убывает с расстоянием по одному и тому же закону в любом направлении. Ионная связь не обладает насыщаемостью. Поэтому к данному иону может присоединиться различное число ионов противоположного знака. Это число определяется относительными размерами взаимодействующих ионов, а также тем, что силы притяжения разноименно заряженных ионов должны преобладать над силами взаимного отталкивания, действующими между ионами одного знака. Металлическая связь Картина электронного строения твердых металлов показывает, что валентные электроны, осуществляющие химическую связь, принадлежат не двум или нескольким определенным атомам, а всему кристаллу металла. При этом валентные электроны способны свободно перемещаться в объеме кристалла. Образованную подобным образом химическую связь называют металлической связью, а совокупность «свободных» электронов в металле — электронным газом. Металлическая связь характерна для металлов, их сплавов и интерметаллических соединений
|