Комплексные соединения
Комплексными называются соединения высшего порядка, в узлах кристаллической решетки которых находятся комплексные ионы, способные к самостоятельному существованию в растворе. Комплексные соединения образуются при сочетании электронейтральных, насыщенных молекул (с позиции классического понятия «валентность») простых и сложных веществ. Например: BF3 + HF = H[BF4]; KNO3 + AgNO3 = K[Ag(NO3)2]. Структура комплексного соединения состоит из внутренней (координационной) и внешней сфер. Более тесно связанные частицы внутренней сферы называют комплексным ионом или комплексом. При написании координационной формулы эту часть комплексного соединения заключают в квадратные скобки. Внутренняя сфера состоит из центральной частицы – комплексообразователя (иона или атома) и окружающих его лигандов (аддендов). Роль комплексообразователей чаще всего выполняют катионы переходных металлов, реже анионы или нейтральные молекулы. Лигандами могут быть кислотные остатки и ионы гидроксила (Cl–, NO3–, СN–, ОН– и др.), электронейтральные молекулы (Н2О, СО и др.), а также те и другие одновременно. Количество лигандов, располагающихся вокруг комплексообразователя, называется координационным числом (к.ч.). За пределами внутренней сферы находится внешняя сфера, содержащая положительно заряженные ионы, если комплексный ион заряжен отрицательно и отрицательно заряженные ионы, если комплексный ион заряжен положительно. В случае незаряженной внутренней сферы внешняя сфера отсутствует. Например, K2[PtCl4]: Pt+2 – комплексообразователь; Cl– - лиганд; [PtCl4]2– – комплексный ион, внутреняя координационная сфера; K+ – внешняя координационная сфера; 4 – координационное число. Координационные числа комплексообразователей (центральных атомов) в растворах могут меняться в зависимости от их заряда:
Для объяснения и расчета химической связи в комплексных соединениях существуют несколько теорий (метод валентных связей, теория кристаллического поля, метод молекулярных орбиталей), которые основаны на положениях квантовой химии. При растворении ионы внешней сферы легко отщепляются, и комплексное соединение практически нацело диссоциирует на внутреннюю и внешнюю сферы: K2[PtCL4] ⇄ 2K+ + [PtCl4]2–. Эта диссоциация называется первичной. Обратимый распад внутренней сферы комплексного соединения называют вторичной диссоциацией:
В результате вторичной диссоциации устанавливается равновесие, которое характеризуется константой равновесия, называемой константой нестойкости комплексного иона:
Чем меньше константа нестойкости, тем более устойчив данный комплексный ион. Номенклатура комплексных соединений. Названия комплексных соединений составляют по следующим правилам: 1. Первым в именительном падеже называют анион, а потом в родительном – катион. 2. При составлении названия сначала перечисляют в порядке увеличения их сложности: лиганды-анионы, лиганды-молекулы, лиганды-катионы, а затем указывают центральный атом. Если центральный атом входит в состав комплексного катиона, то используют русское название элемента, а в скобках римскими цифрами указывают степень его окисления. Если центральный атом входит в состав комплексного аниона, то употребляют латинское название этого элемента, после него римской цифрой обозначают степень окисления, а в конце прибавляют суффикс «ат». Названия нейтральных комплексных частиц образуют так же, как и катионов, но комплексообразователь называют в именительном падеже, а степень его окисления не указывают, так как она определяется электронейтральностью комплекса. 3. К названиям лигандов-анионов прибавляют окончание «о» (Cl– – хлоро, CN– – циано). Названия нейтральных лигандов окончания «о» не имеют (вода – аква, NH3 – аммин). Число лигандов указывают приставками: ди-, три-, тетра- и т.д., образованными от греческих числительных.
|

 ⇄
⇄  .
.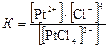 .
.


