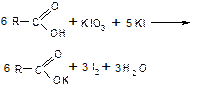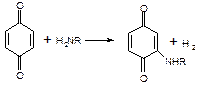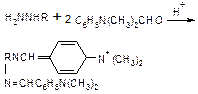органических веществ
Аналитические реакции, используемые для определения функциональных групп, отличаются от реакций катионов и анионов в неорганическом анализе. Ионы в растворе находятся в свободном состоянии и очень реакционноспособны, в то время как функциональные группы связаны с алифатическими или ароматическими фрагментами, а иногда и с обоими одновременно. Прочность этой связи в разных молекулах сильно различается. Это объясняет тот факт, что чувствительность определения функциональной группы зависит от природы анализируемого соединения.
В систематическом органическом анализе функциональные группы идентифицируют после проведения предварительных испытаний и качественного элементного анализа. Не рекомендуется начинать исследование функциональных групп в совсем неизвестном веществе. В случае, когда имеется предварительная информация о веществе и необходимо ее подтверждение, идентификация определенных функциональных групп имеет решающее значение.
В органическом химическом анализе термин «функциональная группа» относится не только к группам, связанным с основной частью молекулы (карбоксильная, гидроксильная, амино-, нитрогруппа и т.д.), но и к углерод-углеродным двойной и тройной связям, которые можно обнаружить с помощью химических реакций. Этот же термин включает понятие ароматического или алифатического характера молекулы. В связи с этим реакции функциональных групп свидетельствуют не только о наличии или отсутствии их в молекуле, но также дают информацию о структуре молекулы, поскольку поведение функциональных групп зависит от их положения в молекуле и различных взаимодействий.
Основные реакции функциональных групп органических соединений приводятся ниже на основе следующей классификации (табл. 3):
– производные алифатических углеводородов;
– ароматические углеводороды и их производные;
– ненасыщенные соединения;
– соединения, содержащие гидроксильную группу;
– соединения, содержащие кетогруппу;
– соединения, содержащие азот;
– соединения, содержащие галогены;
– соединения, содержащие серу.
Эта система отличается от классификации катионов и анионов в неорганическом анализе, где возможно определить любой катион в ходе систематической обработки образца. Благодаря технике разделения можно последовательно определить несколько катионов, в то время как методом исключения можно установить присутствие или отсутствие данного аниона. Методика исключения применяется и в анализе функциональных групп, при этом важно знать результаты предварительных испытаний и данные качественного элементного анализа, которые дают ценную информацию о химических свойствах вещества. Например, если в веществе не обнаружены гетероэлементы, а есть только углерод, водород и кислород, его следует отнести к группам 1–5. В случае отсутствия кислорода это должен быть алифатический или ароматический углеводород. Если вещество содержит углерод, водород и кислород, сначала устанавливают его характер: ароматический или алифатический, насыщенный или ненасыщенный, а затем его испытывают на присутствие гидроксильных или кетогрупп. В присутствии гетероэлементов (азота, серы или галогенов) ситуация становится более сложной, так как наряду с гетероэлементом молекула может содержать любые другие углеродсодержащие функциональные группы. Таким образом, после обнаружения гетероэлемента вещество испытывают также на содержание других упомянутых выше функциональных групп.
Таблица 3. Основные реакции функциональных групп органических соединений
| № n/n
| Название функциональной группы
| Строение
| Реагенты
| Аналитический сигнал
| Аналитическая реакция
| Селективность аналитической реакции
| |
|
|
|
|
|
|
| | 1.
| Алифатические углеводороды
| 
| Бром в СCl4
| Выделение не растворимого в ССl4 бромводорода с резким запахом
| Cn H2n+2 + Br2 ®
Cn H2n+1 Br + HBr
(реакция протекает на свету)
| Малоселективна. Мешают ненасыщенные соединения (п.3.1)
| | 2.
| Ароматические углеводороды (арены)
|

| Серная кислота, конц. H2SO4 (к.)
| Растворение углеводородного слоя
| 
| Малоселективна. Мешают ненасыщенные соединения, спирты, галогенпроизводные
| | AlCl3 с хлороформом
| Появление окраски (может быть различной в зависимости от состава арена)
|  трифенилметан,
далее образование окрашенного s-комплекса типа
(C6H5)3 CH+ (AlCl4)–
трифенилметан,
далее образование окрашенного s-комплекса типа
(C6H5)3 CH+ (AlCl4)–
| Бензол, алкилбензолы – желтая окраска, антрацен, нафталин – голубовато-зеленая, фенантрен – красная
| Продолжение табл. 3
|
|
|
|
|
|
|
| | 3.
3.1
| Ненасыщенные соединения
Этиленовая связь (алкенная)
| – С = С –
|
KMnO4 в нейтральной или слабощелочной среде
|
Обесцвечивание реагента, выпадение коричневого осадка
|
3 R–CH=CH–R + 2 KMnO4 + 4 H2O ® ® 3 (R–CHOH)2 + 2KOH +2 MnO2¯
|
Мешают алкины, альдегиды, тиоспирты, тиокетоны
| | 3.2
| Ацетиленовая связь (алкинная)
|
– С = С –
| Бром в СCl4
| Желтая окраска исчезает
| R–CH=CH–R + Br2 ®
® R–CH(Br)CH(Br)–R
| Мешают алканы (п.1)
| | Соли Cu(I)
(Hg (II))
| Образование красно-корич-невого осадка карбида меди
| 2 Cu+ + HC=CH + 2 NH3 ®
® Cu2C2 ¯ + 2 NH4+
| Мешают ионы, образующие осадки с солями меди и ртути (сульфиды, тиоспирты и др.)
| | 4.
| Соединения, содержащие гидроксильные группы
|
– ОН
| Na (металл.)
| Выделение водорода
| 2 ROH + 2 Na ® 2 RONa + H2
| Неспецифична. Мешают тиоспирты RSH, алкины, вода
| | Диазонийбензолсульфокислота
| Образование окрашенных в красный цвет производных
| HO3SC6H4N+=N + C6H5OH ®
® HO3SC6H4N=NC6H4OH + H+ ;
HO3SC6H4N+=N + ROH ®
® HO3SC6H4N=NOR + H+
| Мешают ароматические амины и соединения, содержащие метиленовые группы
|
Продолжение табл. 3
|
|
|
|
|
|
|
| | 4.1
| Одноатомные спирты
| – ОН
| Щелочной раствор йода
| Образование желтого осадка иодоформа
| R–CH(OH)CH3 + NaIO ®
® NaI + H2O + R–C(O)CH3 ;
R–C(O)CH3 + 3NaIO ®
® R–C(O)CI3 + 3NaOH;
R–C(O)CI3 + NaOH ®
® R–COONa + CHI3 ¯
| Hecпецифична.
Мешают уксусный альдегид, метилкетоны
| | ZnCl2 в солянокислом растворе
| Образование нерастворимого слоя алкилхлорида
| 

| Третичные спирты реагируют сразу, вторичные – через 5 мин, первичные алифатические – не реагируют
| | 4.2
| Многоатомные спирты
| RCHCHR OH OH
| CuSO4 в щелочной среде (реактив Фелинга)
| Образование окрашенных в синий цвет комплексов
| Cu 2+ + 2 C3H5 (OH)3 ®
® [Cu(C3H8 O3)2]2+
| Мешают соединения, восстанавливающие реактив до Сu2O (см. п.5.1)
| | 4.3
| Фенолы
| 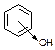
| Бромная вода
| Образование осадков белых трибромфенолов
| C6H5OH + 3 Br2 ®
® C6H5 (OH)Br3 ¯ + 3 HВr
| Мешают растворимые в воде непредельные соединения (см. п. 3.1)
|
Продолжение табл. 3
|
|
|
|
|
|
|
| |
|
|
| FeCl3
| Образование окрашенных производных
| C6H5OH + FeCl3 ®
® [Fe(OC6H5)6]3– + 6H+ + 3Cl –
| Фенол, резорцин, a-нафтол – фиолетовая окраска, крезолы – синяя, b-нафтол, пирокатехин – зеленая
| | 5.
5.1
| Соединения, содержащие кетогруппы
Альдегиды и кетоны
|
= С = О
R¢–CO–R
|
Фенилгидразин
|
Образование белого осадка
|
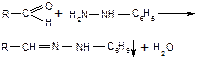
|
Специфична для альдегидов и кетонов
| | 2,4-Динитрофенилгидразин
| Образование маслянистого, быстро кристаллизующегося осадка
| 
| Специфична для альдегидов и кетонов
| | Бисульфит натрия
| Образование кристаллического осадка
|

| Специфична для альдегидов и кетонов
|
Продолжение табл. 3
|
|
|
|
|
|
|
| |
|
|
| Аммиачный раствор оксида серебра (I) (реактив Толленса)
| Выделение металлического серебра (реакция «серебряного зеркала»)
| 
| Специфична для альдегидов
| |
|
|
| Реактив Несслера (K2[HgI4])
| Образование серого осадка
| 
| Специфична для альдегидов
| | Реактив Фелинга (Сu2+ в виде тартрата)
| Образование кирпично-красного осадка оксида меди (I)
| 
| Мешающее влияние могут оказывать многоатомные спирты (см. п. 4.2)
|
Продолжение табл. 3
|
|
|
|
|
|
|
| |
|
|
| Фуксинсернистый реактив (реактив Шиффа)
| Образование продукта реакции фиолетово-красного цвета
|  бесцветная форма
бесцветная форма
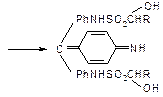 окрашенная форма
окрашенная форма
| Мешают соединения, окисляющие сернистую кислоту
| | Анилин в уксусной кислоте
| Образование окрашенных в коричневый цвет производных
| RCHO + 2 H2N–C6H5 ®
® RCH–(NHC6H5)2;
C6H5CHO + 2 H2N–C6H5 ®
® C6H5CH=N–C6H5 + H2O
| Специфична для альдегидов
| | Тиобарбитуровая кислота
| Образование желтого осадка
| 
| Селективна для a, b-ненасыщенных и ароматических альдегидов
| Продолжение табл. 3
|
|
|
|
|
|
|
| |
|
|
| Нитропруссид натрия
| Появление красновато-желтой окраски, переходящей в фиолетовую при подкислении
| [Fe(CN)5NO]2– + CH2C(O)CH3 + 2OH– → [Fe(CN)5 ON=CHCOCH3]4–+
+ 2H2O
| Специфична для кетонов, содержащих метиленовую группу – CH2–CO–
| | 5.2
| Простые эфиры (алкоксильные группы)
|
R–O–R¢
| Иодоводородная кислота (метод Цейзеля)
| Образование красного осадка с летучими алкилиодидами
| R–O–R¢ + HI ® R–OH + R¢I
R¢I + Hg(NO3)2 ®
® 2R¢NO3 + HgI2 ¯
| Специфична для алкоксильных групп
| | 5.3
| Карбоновые кислоты
|

| Смесь иодата и иодида калия
| Образование коричневой окраски
| 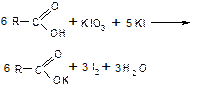
| Характерна для карбоновых кислот
| | Этиловый спирт, конц. H2SO4
| Образование при нагревании сложного эфира с фруктовым запахом
| 
| Характерна для карбоновых кислот
|
Продолжение табл. 3
|
|
|
|
|
|
|
| | 5.4
| Сложные эфиры
| 
| Гидроксиламин, КОН, FeCl3
| Появление красной или фиолетовой окраски
| 
| Мешают галогенангидриды и ангидриды кислот
| | 6.
6.1
| Азотсодержащие соединения
Амины
|
R–NH2
|
Хлороформ, щелочь
|
Образование изонитрила с тошнотворным запахом
|
RNH2 + CHCl3 + 3NaOH ®
® RC=N + 3NaCl + 3 H2O
|
Общая реакция для алифатических и ароматических аминов
| | Нитрит натрия, солянокислый
раствор
| 1. Выделение пузырьков азота
| RNH2 + HNO2 ®
® ROH + N2 + H2O
| Специфична для первичных алифатических аминов
| | 2. Образование кристаллического осадка или маслянистого слоя нитрозоаминов
| RNH2 + HNO2 ®
® R2NNO ¯ + H2O
| Специфична для вторичных алифатических аминов
|
Продолжение табл. 3
|
|
|
|
|
|
|
| |
|
|
|
| 3. Изменений не наблюдается, но после добавления раствора
b-нафтола – оранжевое окрашивание
| Å
Ar NH3 + HNO2 ®
Ar – N=N +2 H2O;
Å
Ar – NºN + С10H7OH ®
Ar – N=N–С10H7OH + H+
| Реакции специфичны для ароматических аминов
| | Нингидрин
| Появление голубой, красной или фиолетовой окраски
| 
| Специфична для аминокислот, первичных, вторичных аминов. Третичные и ариламины не реагируют
| | 1,4-Бензохинон
| Появление пурпурной, красной или оранжевой окраски
| 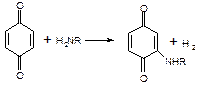
| Специфична для первичных, вторичных и третичных аминов
| |
6.2
|
Гидразины
|
H2NNHR
| Пентацианоаминферрат(II) натрия
| Образование красного или фиолетового раствора, выделение аммиака
| H2NNHR + Na3[Fe(CN)5NH3] ®
® NH3 + Na3[Fe(CN)5NH2NHR]
| Специфична для иминных групп
| Продолжение табл. 3
|
|
|
|
|
|
|
| |
|
|
| n-Диметиламинобензальдегид
| Оранжевая или красно-фиолетовая окраска раствора
| 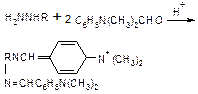
| Мешают первичные ароматические амины и гетероциклические соединения (индол, пиррол)
| | 6.3
| Нитросоединения
|
RNO2
| Цинк в присутствии хлорида аммония и реактива Толленса
| Образование аминофенолов, реагирующих с Ag2O (п.5.1) с образованием темного осадка серебра
| RNO2 + 4H ® RNHOH + H2O
RNHOH + 2 [Ag(NH3)]OH ®
® R–N=O + 4NH3 + 2H2O + Ag ¯
| Мешают соединения, реагирующие с реактивом Толленса (п. 5.1)
| | Гидроксид железа (II)
| Образование темно-коричневого осадка
| RNO2 + 6 Fe(OH)2 + 4 H2O ®
® 6 Fe(OH)3 ¯ + RNH2
| Амины можно обнаружить согласно п. 6.1
| | Раствор NaOH
| Образование соли ациформы с интенсивной окраской (желтой, оранжевой или красной)
| 
| Специфична для ароматических нитросоединений
| | Дифенил-амин в конц. H2SO4
| Образование окрашенных в синий цвет продуктов
| 
| Мешают неорганические нитриты, нитраты
| Окончание табл. 3
|
|
|
|
|
|
|
| |
| Серосодержащие соединения (меркаптаны)
|
RSH
| Иодазидный реагент
| Выделение пузырьков азота
| NaN3 + I2 ® 2 NaI + 3 N2 ,
RSH – катализатор реакции
| Специфична для тиоспиртов
| | Ионы тяжелых металлов (Cu2+, Ag +, Hg2+, Pb2+)
| Образование темных осадков меркаптидов
| R–SH + Ag + ® R–SAg ¯ + H+;
4 R–SH + Cu2+ ®
® 2 CuS–R ¯ + R–S–S–R + 4 H+
| Мешают неорганические ионы, образующие осадки с ионами тяжелых металлов
| | Азотистая кислота
| Появление красной или зеленой окраски раствора
| RSH + ONOH ® R–S–N=O + H2O
| Специфична для соединений с SH-группами
| |
|
Галогенсодержащие соединения
|
Cl –, Br –, I –
| Нитрат серебра в этаноле
| Образование осадков галогенидов серебра
| AgNO3 + RCl ® RNO3 + AgCl ¯
AgNO3 + RBr ® RNO3 + AgBr ¯
AgNO3 + RI ® RNO3 + AgI ¯
| Специфична для галогенпроизводных
| | Иодид натрия в ацетоне
| Выделение белых осадков хлорида и бромида натрия, не растворимых в ацетоне
| NaI + RBr ® NaBr ¯ + RI
NaI + RCl ® NaCl ¯ + RI
| Специфична для бром- и иодзамещенных (проводится в неводном растворе!)
|

Композиция из абстрактных геометрических фигур Данная композиция состоит из линий, штриховки, абстрактных геометрических форм...
|

Важнейшие способы обработки и анализа рядов динамики Не во всех случаях эмпирические данные рядов динамики позволяют определить тенденцию изменения явления во времени...
|

ТЕОРЕТИЧЕСКАЯ МЕХАНИКА Статика является частью теоретической механики, изучающей условия, при которых тело находится под действием заданной системы сил...
|

Теория усилителей. Схема Основная масса современных аналоговых и аналого-цифровых электронных устройств выполняется на специализированных микросхемах...
|
|
Тактика действий нарядов полиции по предупреждению и пресечению правонарушений при проведении массовых мероприятий К особенностям проведения массовых мероприятий и факторам, влияющим на охрану общественного порядка и обеспечение общественной безопасности, можно отнести значительное количество субъектов, принимающих участие в их подготовке и проведении...
Тактические действия нарядов полиции по предупреждению и пресечению групповых нарушений общественного порядка и массовых беспорядков В целях предупреждения разрастания групповых нарушений общественного порядка (далееГНОП) в массовые беспорядки подразделения (наряды) полиции осуществляют следующие мероприятия...
Механизм действия гормонов а) Цитозольный механизм действия гормонов. По цитозольному механизму действуют гормоны 1 группы...
|
|
Неисправности автосцепки, с которыми запрещается постановка вагонов в поезд. Причины саморасцепов ЗАПРЕЩАЕТСЯ: постановка в поезда и следование в них вагонов, у которых автосцепное устройство имеет хотя бы одну из следующих неисправностей:
- трещину в корпусе автосцепки, излом деталей механизма...
Понятие метода в психологии. Классификация методов психологии и их характеристика Метод – это путь, способ познания, посредством которого познается предмет науки (С...
ЛЕКАРСТВЕННЫЕ ФОРМЫ ДЛЯ ИНЪЕКЦИЙ К лекарственным формам для инъекций относятся водные, спиртовые и масляные растворы, суспензии, эмульсии, новогаленовые препараты, жидкие органопрепараты и жидкие экстракты, а также порошки и таблетки для имплантации...
|
|




 трифенилметан,
далее образование окрашенного s-комплекса типа
(C6H5)3 CH+ (AlCl4)–
трифенилметан,
далее образование окрашенного s-комплекса типа
(C6H5)3 CH+ (AlCl4)–


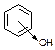
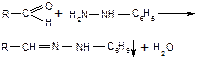





 бесцветная форма
бесцветная форма
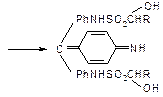 окрашенная форма
окрашенная форма