З курсу«Електрорадіоматеріали» Київ – 2014
Тема 1. Вступ. Хімія та електроматеріали План лекції: 1. Предмет та задачі дисципліни, її місце в навчальному процесі. 2. Основні поняття хімії. Будова атома, енергетичні рівні, періодичний закон Менделєєва. 3. Будова молекули, хімічні зв’язки. Література до вивчення лекції: 1. Пасинков В.В., Сорокин В.С. Материалы електронной техники. – М.: Высш. Школа, 1986, с. 9-14, 28-34 2. Толюпа С. В., Латипов І. М., Еремеєв Ю.І., Електричні матеріали. Пасивні електронні елементи інфокомунікаційних систем та мереж. навч. посібник, 2010р. 3. Богородицкий Н.Л., Пасынков В.В., Тареев Б.М. „Электротехнические материалы”. Л.:Энергоатомиздат, 1985. — 304 с. 4. Рычина Т.А., Зеленский А.В. „Устройства функциональной электроники и электрорадиоэлементы”. М.: Радио и связь, 1989. — 352 с. 5. Панфилов И.П., Флейта Ю.В. „Техническая электроника. Учебное пособие — ОЭИС им. О.С.Попова”. Одесса, 1990.- 75 с. 6. Гершунский Б.С. „Основы электроники и микроэлектроники”. — Киев, Высш. школа, 1989. 423 с. 7. Справочник по электротехническим материалам. Под редакцией Корицкого В.В. и др. М.: Энергоатомиздат в 3-х томах, 1986-88 г. 8. Терещук Р.М. и др. Справочник радиолюбителя. Киев, Наукова думка, 1989. — 800 с. Навчально-матеріальне забезпечення (наочні посібники,схеми, таблиці, ТЗН та інше ) 1. Таблиця «Періодична система Д.І. Мендєлєєва» 1. Предмет та задачі дисципліни, її місце в навчальному процесі. Навчальна дисципліна „Хімія та електроматеріали” виникла в зв’язку з необхідністю вивчення властивостей електроматеріалів, які застосовуються в сучасних електроних приладах, техніці зв’язку. Вона вміщує три розділи: - хімія; - електротехнічні матеріали; - радіодеталі; В роздiлi „Хімія” розглядаються основи хімічних знань: будова атомів та молекул речовини, хімічний склад, структура та властивості речовин, хiмiчнi зв’язки, електричні властивості молекул, залежність властивостей речовини від структури молекул, періодична система елементів i т.п. В роздiлi “Електротехнічні матеріали” даються поняття про фізико-хімічні, електричнi, механічні властивості провідників, напiвпровiдникiв, діелектриків та магнітних матеріалів та їх застосування. В роздiлi “Радiодеталi” вивчаються властивостi резисторiв, конденсаторiв та котушок iндуктивностi та їх застосування в пристроях зв’язку та управління. Матеріали даної навчальної дисциплiни необхiдні для розумiння проблем сучасної радiоелектронiки, яка складається з напiвпровiдникової, молекулярної, квантової та вакуумної електронiки. Розвиток усiх галузей застосування радiоелектронiки тісно пов’язаний з розробкою та застосуванням нових сучасних електроматерiалiв, пiдвищенням рiвня технологiй їх виготовлення, фiзичних та хiмiчних властивостей. Для зрозумiння ролi електроматерiалiв у радiоелектронiцi, як приклад, розглянемо умови, за яких можлива передача електричних сигналiв по дротовiй лiнi зв’язку. Це можливо, коли вона має високу провiднiсть, а пронiдники — добре iзольованi один нiд одного та вiд землi. Цi вимоги можуть бути виконанi завдяки застосуванню вiдповiдних електроматерiалiв. Якiсть та ефективнiсть роботи системи передачi сигналiв буде залежати вiд якостi тих матерiалiв та деталей, якi застосовуються. Особливо велике значения мають електроматерiали, iз яких створюється елементна база радiоелектронної апаратури, до якої входять: iнтегральнi мiкросхеми (ІМС), напiвпровiдниковi прилади, електроннi лампи, знаковi iндикатори, резистори, конденсатори, котушки iндуктивностi, комутацiйнi прилади, магнiтнi елементи i т. iн. До матерiалiв, iз яких вона виготовляеться, належать: - провiдники; - напiвпровiдники; - дiелектрики; - магнiтнi матерiали. Провiдники — це металевi матеріали з великою електропровiднiстю, яка обумовлена наявнiстю великї кiлькiсті вiльних електронiв. Застосовуються для електричних кабелiв та проводiв, виводiв електронних елементiв і т. ін. Напiвпровiдники — це матерiали, якi мають меншу електропровiднiсть, оскiльки у них значно менша кiлькiсть вiльних електронiв. Застосовуються для виготовлення ІМС, транзисторiв, тощо. Дiелектрики — це матерiали, якi мають незначну електропровiднiсть, оскiльки кiлькiсть вiльних електронiв дуже мала. Застосовують для електричної iзоляцiї проводiв, в конденсаторах i т. iн. Магнiтнi матерiали — це матерiали, якi мають магнiтнi властивостi. Застосовують в осердях котушок iндуктивностей, трансформаторiв, дроселiв, елементiв пам’ятi рiзних типiв. Заняття з навчої дисципліни “Хiмiя та електроматерiали” проводяться в одному семестрі на всiх факультетах. Загальна кiлькiсть годин — 108, з них пiд керiвництвом викладача — 54: 18 лекцій, 18 лабораторних занять, 18 практичних. В кінцi винчення – іспит. Поточний контроль знань, засвоєння матеріалу проводиться за допомогою засобів модульного контролю. Передбачено виконання комплексного семестрового завдання призначеного для самостійної роботи і являє собою індивідуальне завдання по основних видах матеріалів електронної техніки. При вивченні дисципліни рекомендується наступна література: 2. Основні поняття хімії. Будова атома, енергетичні рівні, періодичний закон Менделєєва. В роздiлi „Хімія” розглядаються основи хiмiчних знань: будова атомiв та молекул речовини, хiмiчний склад, структура та властивовтi речовин, хiмiчнi зв’язки, електричнi властивостi молекул, залежнiсть властивостей речовини вiд структури молекул, перiодична система елементiв i т. ін. Поняття про будову атома. Будь-яка речовина складається з атомів і молекул. Згідно з планетарною моделлю атом складається з масивного ядра з позитивних зарядів і електронів, які обертаються навколо нього. Негативний заряд електронів дорівнює позитивному заряду ядра, тобто атом в цілому нейтральний. В ядрі атома зосереджена майже уся його маса. Розмір атома приблизно дорівнює 10-18 см, ядра – 10-13 см. Тобто ядро приблизно в 105 разів менше атома. Розглянемо найпростіший атом – атом гідрогену Н. Він має один електрон, який обертається по колу навколо позитивно зарядженого ядра. Позитивно заряджене ядро атома гідрогену Н з масою 1,67×10-24 г називається протоном (рис.1).
Рис. 1 Модель атома
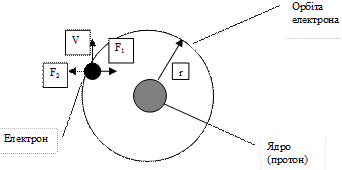
Протони входять до ядер атомів різних елементів. Крім того в ядрі більшості елементів знаходяться нейтрони, які мають масу протона, але не мають заряду. На електрон при його русі діє сила тяжіння до ядра F 1 та відцентрова сила F 2, які визначаються за формулами
де q – заряд електрона (1,6×10-19 кл); r – радіус орбіти електрона; m – маса електрона; V – окружна швидкість електрона. Умова рівноважного нейтрального стану атома відповідає рівнянню F 1 = F 2 Тоді:
Гідроген Н відноситься до хімічних елементів. Хімічний елемент – це вид атомів з однаковим позитивним зарядом ядра. Відомо 109 хімічних елементів, які умовно розподіляються на метали та неметали. Атом – це найменша частка хімічного елемента, яка входить до складу молекул простих і складних речовин. Хімічні властивості атома визначаються його складом. Енергетичні рівні електронів атомів хімічних елементів Властивості хімічних елементів багато в чому пояснюються розміщенням електронів в атомах. В будь-якому атомі можливо існування декількох електронних орбіт (електронних шарів) із різними відстанями від ядра. Ці електронні шари інакше звуться енергетичними рівнями. Вони характеризують запас енергії електронів. Найменшу енергію мають електрони, які знаходяться поблизу ядра (перший енергетичний рівень). Електрони подальших рівнів будуть мати більші запаси енергії Звичайно, електрони зовнішнього рівня матимуть найбільший запас енергії i тому вони менше пов’язані з ядром (рис. 2). При прикладанні до атома енергії електрони різних шарів (рівнів) можуть переходити на більш віддаленні від ядра енергетичні рівні. Електрони верхнього рівня одних атомів можуть переходити до верхніх рівнів інших атомів. В цих випадках атом iонiзується. При відриві електрона атом стає позитивним іоном, після приєднання — негативним іоном. Енергія електрона W складається із суми потенційної U та кінетичної Т енергії
де U = —,
В атомі можливо існування електронних орбіт із довжиною кола, на якій укладається ціла кількість електронних хвиль. Це відповідає співвідношенню:
де n — ціле число (номер рівняння) 1, 2, 3,...; h — стала Планка, яка дорівнює 6,624×10-27 ерг/с.
Рис.2. Енергетичні рівні атома
Тоді
де знак “ — “ показує, що електрони віддаляються від ядра. Переведення електрона на більш віддалену орбіту пов’язано з витратою енергії. При переході електрона з орбіти n2 на орбіту n 1 його енергія зміниться на величину
Використовуючи рівняння (1.1.) та (1.2.), знайдемо радіус орбіти r та окружну швидкість V електрона при n = 1 (в атомі гідрогену).
Рис. 3. розподілення електронів по енергетичним рівням атома.
Як приклад розміщення елементів у таблиці розглянемо будову атомів елементів 3 періоду (рис. 4).
Рис. 4. Будова атома Na з 3 – го періоду таблиці Менделєєва
Перший елемент цього періоду – натрій Na, його номер за порядком – 11, тобто позитивний заряд ядра дорівнює +11, кількість електронів дорівнює також 11. Натрій Na знаходиться у 3 періоді, тому його електрони розміщуються на 3-х рівнях. На зовнішньому рівні обертається 1 електрон, тому елемент знаходиться в першій групі і є одновалентним. Будову атому натрію Na можна зобразити схемою – (+11), 2, 8, 1, тобто: (+11) - заряд ядра, 3 енергетичні рівні (1-й два електрони, 2-й – вісім, 3-й – один). В атомах наступних елементів 3 періоду (від Na до Ar) іде поступове заповнення електронами зовнішнього рівня до 8 і відповідно зростає валентність. Будову останнього елемента 3-го періоду аргону Ar можна записати так: (+18) 2, 8, 8. Більше ніж 8-м електронів на зовнішньому енергетичному рівні розміститись не могуть. Тому починаючи з елемента калію К додається ще один рівень. Тоді будову калію можна записати так: (+19) 2, 8, 8, 1. При поверненні електрона на колишню орбіту атом віддає енергію у виді фотона, яка знаходиться з рівняння h´n = W 1 – W 2 де n — частота коливань фотона, W1, W2 - значення енергії електрона на орбіті n=1 та орбіті n=2 відповідно. Згідно квантової механіки електрону з V=2×108 м/см та m=9.11×10-28 г відповідає довжина хвилі λ =3,5×10-8 см. Тобто з хвилевої точки зору електрони можна уявити як хмару, яка складається з цілої кількості хвиль. Періодичний закон Менделєєва Це — таблиця в якій всі хімічні елементи розміщені у відповідному порядку. Періодична таблиця вміщує 1 09 елементів, якi розміщуються в 7 періодах та 9 групах (табл. 1.). Таблиця 1.
Властивості простих елементів та їх сполук знаходяться у періодичній залежності від значення заряду їх атомів. Хiмiчнi елементи цієї таблиці позначені хімічними знаками Н, О, АІ, Fе i т. iн. Кожний період (крім першого) починається з лужного металу, а закінчується інертним газом. Номер групи пов’язаний з валентністю елемента (вища валентність дорівнює номеру групи). інертні гази не мають валентності. Кількість енергетичних рівнів (електронних шарів) атома дорівнює номеру періоду, в якому знаходиться елемент в таблиці: у атомів елементів 1 -го періоду — один рівень, у 2-го періоду — два i т.д. Кількість електронів на зовнішньому енергетичному ревні у атомів елементів перших трьох періодів дорівнює номеру групи. Але у нульової групі гелій Не має два електрони, iншi атоми інертних газів —8. Найбільша кількість електронів на будь-якому енергетичному рiвнi визначається подвоєним квадратом номера цього рівня n (від ядра) (рис. 1.3) N = 2n2. У вiдповiдностi до цього на першому енергетичному рiвнi може знаходитись не більше 2—х електронів, на другому — не більше 8, на третьому не більше 1 8, на четвертому — не більше 32...
3. Будова молекул, хімічні зв’язки. Молекула - це найменша частина даної речовини, яка має її хімічні властивості. Молекули простих речовин складаються з атомів одного i того ж хімічного елемента. Наприклад, молекула нітрогену Н2 складається з двох атомів елемента нітрогену. Молекули складних речовин (хімічних сполук) складаються з атомів різних елементів. Наприклад, молекула води складається з двох атомів гідрогену Н2 та одного атома оксигену О. I хімічна формула — Н2O. Явища, при яких одні речовини перетворюються в iншi з різним відносно перших складом та властивостями, називаються хімічними. Наприклад, ржавіння заліза, горіння, отримання металів із руд i т. ін. Явища, при яких зманюється форма або фізичний стан речовини, називаються фізичними. При фізичних явищах склад речовини не зманюється, тобто не виникають нові речовини. Наприклад, згинання дроту, ковка заліза, подрібнення солі, плавлення металів, перетворення води у пар i т. iн. Часто хiмiчнi явища супроводжуються фізичними. Наприклад, при згорянні вугілля видаляється тепло, в акумуляторі під дією хімічних процесів виникає електричний струм.
Валентні електрони. Хiмiчнi зв’язки атомів Сталий стан простих речовин забезпечується поєднанням їх атомів в молекули. Це відбувається з наближенням атомів на відстань, близьку до їх радіусів. Таким чином одна з умов виникнення хімічного зв’язку — це ущільнення речовини. При цьому з’являються електричні сили взаємного притягання або відштовхування атомів у залежності від властивостей електронів на зовнішніх рівнях атомів. Таким чином, хімічний зв’язок атомів обумовлений електричними та магнітними силами взаємодії електронів та ядер. Електрони, якi приймають участь в утворенні хімічних зв’язків називаються валентними. Вони знаходяться в незаповнених електронних шарах атома i можуть бути не тільки електронами першого зовнішнього шару, але i другого, i третього. Валентністю називається властивість атома даного елемента приєднувати визначену кількість атомів інших елементів. Усі елементи за валентністю можна розподілити на три групи: — із постійною валентністю: Н Nа, К (одновалентні), Са, Ва, Rа (двовалентні), Al (тривалентний); — із змінною валентністю: карбон у складі СО є двовалентний, а в сполуці СО2 — чотиривалентний; — в яких відсутня валентність: інертні гази — гелій Не, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn. За характером з’єднань атомів між собою розрізняють такі основні види хімічного зв’язку: ковалентний, полярний, іонний, донорно — акцепторний, металевий, міжмолекулярний. Ковалентний зв’язок — характеризується об’єднаннями електронних шарів однойменних атомів. Атоми речовин із ковалентним зв’язком об’єднуються між собою валентними електронами спільних шарів. Отримані речовини є сталими сполуками. Іонний зв’язок— характеризується притяганням позитивних та негативних iонiв. Це зв’язок металів із неметалами. В цих сполуках валентні електрони атомів метала переходять до атомів металу й зв’язок між ними утворюється за рахунок електростатичної взаємодії з’явившихся iонiв позитивно ти негативно заряджених, що утворилися. Металевий зв’язок — характеризується взаємодією позитивних iонiв кристалічних гратiв метала та вільних електронів. Цей зв’язок пояснює наявність високої електропровідності металів. Атоми металу легко віддають валентні електрони, перетворюючись у позитивно заряджені iони. Легкість виходу електронів з атомів визначає хімічну активність металів. В залежності від хімічної активності у воді метали розрізняються між собою та розміщуються в ряду напруг — від лiтiю Li до золота Au
Міжмолекулярний зв’язок – характеризується наявністю сили притягання молекул речовини між собою. Цей зв’язок має визначне значення для діелектричних, механічних та інших властивостей. Особливо міцні міжмолекулярні зв’язки у полімерів: капрону, нейлону та ін. Доноро-акцепторний зв’язок – характеризується тим, що атоми деяких елементів (домішкових) віддають по одному електрону в кристалічні грати основного елемента (такі атоми звуться донорними) або захоплюють один електрон з основного елемента (такі атоми звуться акцепторними). Донорні атоми постачають енергію в зону вільних рівнів і створюють у речовині електронну електропровідність – типа n (negative). Акцепторні атоми утворюють вільні рівні енергії і діркову електропровідність – типа р (positive). Домішки створюють умови напівпровідності в деяких речовинах (в елементах 4-ї групи таблиці Менделєєва). Наприклад, у германію Ge ( із донорною домішкою миш’яку As і акцепторною In), а також, у кремнію Si (із донорною домішкою фосфору P та акцепторною домішкою брому Br або алюмінію Al). Зонна теорія твердого тіла(Енергетичні спектри) Як було зазначено вище, ізольований атом характеризується набором енергетичних рівнів (дискретним енергетичним спектром). Речовина, яка є сукупністю атомів, має енергетичний спектр атомів (набір дискретних рівнів), у виді енергетичних зон (неперервні енергетичні спектри). Виникнення енергетичних зон можна пояснити таким чином. Нехай деяка кількість NA однакових атомів входить до кристалічних грат. З наближенням один до одного атоми починають взаємодіяти, Їх енергетичний стан зманюється, виникає розщеплення рівнів в зонi. Замість одного рівня у окремого атома з’являється NA рівнів у всій сукупності атомів. При розщепленні рівнів виникають три енергетичні зони — валентна зона (ВЭ), зона провідності (ЭП) та заборонена зона (ЭЭ). Зони відрізняються значенням рівнів енергіїб. В деяких випадках зони можуть перекриватися. Валентна зона — це верхня енергетична зона, в якій знаходяться валентні електрони. Зона провідності — с зоною дозволених значень енергії електронів провідності. Якщо між валентною зоною та зоною провідності існує енергетичний зазор, то він відповідає зоні заборонених значень енергії. В цій зоні не існує електронів. Відповідно із шириною заборонено зони ЛИ та пов’язаною з нею електропровідністю, речовини розподіляють на (рис.5): - провідники, для яких ΔW33 = 0 еВ; - напівпровідники з ΔW33 <3 еВ; - діелектрики з ΔW33 >3 еВ.
Рис. 5. Енергетичні зони речовини Велика електропровідність провідників обумовлена наявністю велико кількості вільних (у межах кристала) електронів. Згідно із зонною теорією, ці електрони знаходяться в зоні провідності, де вони можуть займати дискретні, але дуже близько розміщені рiвнi таким чином, що додавання електрону незначної енергії приведе до його переходу в межах цієї зони на більш високі ревні (рис. 6 б,а). В напівпровідниках i діелектриках (ізоляторах) на розрив зв’язку електронів з атомами необхідно витратити досить велику енергію, що відповідає наявності забороненою зони завтовшки ΔW3 (рис. 6 б). При розриві зв’язку електрон стає вільним, тобто переходить у зону провідності, де поводить себе так, як i у металах. На мiсцi електрона, який вийшов iз ВЭ, виникає дірка. Рух дірки пов’язаний з переходом електронів на вакантні зв’язки, тобто на дозволені рiвнi у валентній зоні. При отриманні енергії зовні електрон переходить із нижнього рівня на вищий, а дірка з високого рівня на низький. Тобто весь енергії для дірок спрямована донизу.
Рис. 6. Енергетичні рiвнi: а) провідника; б) напівпровідника та діелектрика
|



 W = U + T
W = U + T (за умови урівноваженості заряду). (1.1.)
(за умови урівноваженості заряду). (1.1.)

 , (1.2)
, (1.2)









