Рівняння стану реального газу. Рівняння Ван-дер-ВаальсаУ реальних газах, на відміну від ідеального, очевидно, не можна нехтувати власним об’ємом молекул та їхньою взаємодією на відстані. Зокрема, за нормальних умов в об’ємі V =1 м3 газу міститься 2,68×1025 молекул. Радіус молекули газу приблизно дорівнює 10-10 м, тоді її власний об’єм V 01=4/3p r 3, а власний об’єм усіх молекул Порівняно з 1 м3 це дуже малий об’єм, яким можна знехтувати, а газ уважати ідеальним. Однак за великих тисків цей об’єм стає суттєвим. Зокрема, при P =500 атм V 0=0,5 м3. За цих умов модель ідеального газу вже не можна застосувати. Отже, в реальному газі вільний об’єм, доступний для руху молекул, є меншим, ніж об’єм посудини, у якій він міститься: Vp=V – b (4.1)
Як і в ідеальному газі, молекули реального газу чинять тиск на стінки посудини, передаючи їм під час удару певний імпульс. Водночас у реальному газі кожна молекула зазнає дії сил притягання з боку інших сусідніх молекул, які пере-бувають у сфері її молекулярної дії. Якщо молекула міститься всередині газу, то сили притягання, що діють на неї з боку інших молекул, взаємно зрівноважені (рис. 4.1). Поблизу стінки ця рівновага порушена, оскільки сфера молекулярної дії молекули лише частково заповнена сусідніми молекулами газу, отже, рух молекули в напрямі до стінки буде сповільненим, а імпульс, переданий нею стінці, – меншим порівняно з імпульсом, що переданий молекулою ідеального газу. Загалом тиск реального газу р є дещо меншим від тиску рі, що його спричинив би за тих самих умов ідеальний газ: р=рі – р в, (4.2) де р в= Описану вище модель реального газу вперше запропонував нідерландський фізик Ван-дер-Ваальс, який вивів рівняння стану для одного моля реального газу у вигляді (р + Поправки а і b – це сталі для кожного газу величини, які визначають дослідним шляхом. Для довільної кількості газу рівняння Ван-дер-Ваальса має вигляд
Рівняння (4.3) можна записати у розгорнутому вигляді
Tk= Критичні параметри залежать від різновиду газу, оскільки, згідно з (4.7) залежать від поправок а і b. Уперше експериментальні ізотерми реального газу отримав англійський фізик Т. Ендрюс, досліджуючи залежність молярного об’єму вуглекислого газу від тиску під час ізотермічного стискання. Ізотерми Ендрюса показані на рис. 4.3. На відміну від ізотерм Ван-дер-Ваальса, за температур Т < Т к на них, замість хвилеподібної, простежується горизонтальна ділянка, коли стискання вуглекислоти не супроводжується зміною тиску. Цій ділянці відповідає двофазовий стан речовини – рідина та насичена пара. Ділянка СD описує стискання газу з підвищенням його тиску. У точці С починається конденсація вуглекислоти, яка закінчується у точці В. За цих умов газоподібна фаза перебуває в стані насиченої пари, тиск якої є сталим. Ділянка ВА відповідає стану рідини з малою стисливістю, про що свідчить велика крутість цієї ділянки графіка. З наближенням температури до критичної протяжність ділянки ВС зменшується, вироджуючись при Т = Т к у точку К, яка відповідає критичному стану речовини. У критичному стані зникає різниця між рідкою і газоподібними фазами, а питома теплота пароутворення і поверхневий натяг дорівнюють нулю. Експериментальні дослідження засвідчують, що деякі стани речовини, які відповідають ділянкам ВС, DЕ та LM (рис. 4.2), можна отримати на практиці. Це так звані метастабільні стани. Зокрема, ділянка ВС описує стан перегрітої рідини, а DЕ – перенасиченої пари. За певних умов можна отримати і „розтягнену” рідину (ділянка LM), тиск у якій менший від зовнішнього. Метастабільні стани є нестійкими.
|

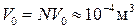 .
. де b – поправка на власний об’єм молекул газу (можна довести, що b =4 NV 0).
де b – поправка на власний об’єм молекул газу (можна довести, що b =4 NV 0).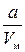 – внутрішній тиск газу, зумовлений взаємодією молекул; Vм –молярний об’єм газу; а – поправка на внутрішній тиск.
– внутрішній тиск газу, зумовлений взаємодією молекул; Vм –молярний об’єм газу; а – поправка на внутрішній тиск.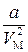 )(V М- b)= RT. (4.3)
)(V М- b)= RT. (4.3)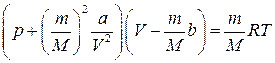 . (4.4)
. (4.4) . (4.5)
. (4.5) Вираз (4.5) – це кубічне рівняння, яке залежно від тиску і температури газу може мати один або три дійсні корені. Ізотерми Ван-дер-Ваальса показані на рис. 4.2. За низьких температур ізотерми мають хвилеподібні ділянки, які з підвищенням температури вироджуються в одну точку перегину К. Цю ізотерму називають критичною, а відповідну їй температуру – критичною Т к. Точці К на графіку відповідають Р к і V к – критичні тиск і об’єм газу. Критичні параметри Т к, Р к і V к можна знайти, скориставшись формулою (4.5) з урахуванням того, що в точці К три корені цього рівняння однакові та дорівнюють V к. Тоді
Вираз (4.5) – це кубічне рівняння, яке залежно від тиску і температури газу може мати один або три дійсні корені. Ізотерми Ван-дер-Ваальса показані на рис. 4.2. За низьких температур ізотерми мають хвилеподібні ділянки, які з підвищенням температури вироджуються в одну точку перегину К. Цю ізотерму називають критичною, а відповідну їй температуру – критичною Т к. Точці К на графіку відповідають Р к і V к – критичні тиск і об’єм газу. Критичні параметри Т к, Р к і V к можна знайти, скориставшись формулою (4.5) з урахуванням того, що в точці К три корені цього рівняння однакові та дорівнюють V к. Тоді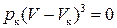 . (4.6)
. (4.6) Порівняємо відповідні коефі-цієнти в (4.5) і (4.6), отримаємо Vк=3b;
Порівняємо відповідні коефі-цієнти в (4.5) і (4.6), отримаємо Vк=3b; , рk=
, рk=  . (4.7)
. (4.7)


