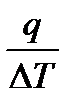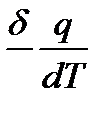ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Предмет химической термодинамики. Термодинамика представляет собой научную дисциплину, которая изучает (1) переходы энергии из одной формы в другую, от одной части системы к другой, (2) энергетические эффекты, сопровождающие различные физические или химические процессы, зависимость их от условий протекания процессов и (3) возможность, направление и пределы самопроизвольного (т. е. без затраты работы извне) течения самих процессов в рассматриваемых условиях. Термодинамика базируется на двух основных законах, называемых иначе первым и вторым принципами термодинамики. Возникновение термодинамики как самостоятельной дисциплины относится к середине прошлого века, хотя некоторые закономерности, играющие в ней большую роль, как, например, закон Гесса, принцип Карно, были установлены значительно раньше. В первый период своего развития термодинамика изучала соотношения только между теплотой и механической работой, т. е. между количеством теплоты, принимаемым или отдаваемым участвующими в процессе телами, и количеством работы, которая может быть получена от системы в результате этих процессов при тех или иных условиях их протекания. Эти вопросы возникали в связи с изобретением и все большим распространением паровых машин. Другие формы энергии первоначально почти не рассматривались термодинамикой. Позднее с открытием и исследованием электрической, лучистой, химической и других форм энергии постепенно в круг рассматриваемых термодинамикой вопросов включается и изучение этих форм энергии. Быстро расширялась и область практического применения термодинамических методов исследования. Уже не только паровая машина и процессы превращения механической энергии в теплоту исследуются на основе законов термодинамики, но и электрические машины, холодильные машины, компрессоры, двигатели внутреннего сгорания, реактивные двигатели. Гальванические элементы, а также процессы электролиза, различные химические реакции, атмосферные явления, некоторые процессы, протекающие в растительных и животных организмах, и многие другие исследуются не только в отношении их энергетического баланса, но и в отношении возможности, направления и предела самопроизвольного протекания процесса в данных условиях. Они исследуются также в отношении установления условий равновесия, определения максимального количества полезной работы, которая может быть получена при проведении рассматриваемого процесса в тех или иных условиях, или, наоборот, минимального количества работы, которое необходимо затратить для осуществления интересующего нас процесса в каких-нибудь заданных условиях. Такое развитие различных прикладных направлений термодинамики постепенно привело к выделению их в самостоятельные разделы; к числу последних относится и химическая термодинамика. Предметом химической термодинамики служит термодинамическое рассмотрение явлений, относящихся к области химии, в частности к физической химии. Химическая термодинамика изучает также зависимость различных термодинамических свойств веществ как от их химического состава и строения, так и от условий существования данного вещества, в частности от температуры и давления. Она изучает также изменения этих свойств при химических и физических процессах. Первый закон термодинамики непосредственно связан с хорошо известным законом сохранения энергии, который устанавливает эквивалентность различных ее форм. Первый закон устанавливает связь между количеством теплоты, полученной или выделенной в процессе, количеством произведенной или полученной работы и изменением внутренней энергии системы. Этот закон является универсальным, и ряд следствий, вытекающих из него, имеет большое значение для физической химии и для решения различных производственных задач. Расчеты энергетического и, в частности, теплового баланса, расчеты тепловых эффектов различных процессов могут быть осуществлены с помощью первого закона. Путем таких расчетов иногда можно вычислить величины, не поддающиеся прямому измерению. Первый закон достаточно прост, хорошо понятен и не требует пространных пояснений. Второй закон позволяет в общей форме определить возможность, направление и предел самопроизвольного течения различных химических процессов в тех или иных условиях, а также состояние равновесия и зависимость его от внешних условий (температуры, давления и пр.), что в свою очередь дает возможность установить, какими должны быть внешние условия, чтобы интересующий нас процесс мог протекать в нужном направлении и в требуемой степени. Все это имеет большое значение для исследования различных теоретических проблем физической химии и для решения задач прикладного характера. Термодинамика и, в частности, химическая термодинамика первоначально развивалась оторванно от атомно-молекулярной теории и учения о строении атомов и молекул. Однако такой односторонний подход к изучаемым явлениям не благоприятствовал дальнейшему развитию термодинамики. Развитие термодинамики пошло по другому пути — по пути использования выводов атомно-молекулярной теории и учения о строении атомов и молекул. Второй закон термодинамики, установленный первоначально чисто эмпирическим путем, получил развитие в статистическом рассмотрении термодинамических явлений. Статистическая термодинамика показала, что термодинамические функции отражают все особенности внутреннего строения вещества и условий его существования; пользуясь этими функциями, мы в суммарной форме отражаем влияние этих особенностей на тепловой эффект реакции, на положение равновесия и пр. Учение о строении молекул дало возможность установить и понять закономерности в тепловых эффектах различных процессов, расширило и углубило понимание химических и фазовых равновесий, дало возможность выявить физический смысл рассматриваемых соотношений. Основные понятия и величины. Следует более точно определить некоторые понятия, термины и величины, используемые в термодинамике, так как недостаточно строгое применение их может привести к ошибочным заключениям. Системой называют тело или группу тел, находящихся во взаимодействии и мысленно обособляемых от окружающей среды. Гомогенной называется такая система, внутри которой нет поверхностей раздела, отделяющих друг от друга части системы, различающиеся по свойствам. Системы же, внутри которых такие поверхности раздела имеются, называются гетерогенными. От этих понятий следует отличать понятия однородной и неоднородной систем. Однородной называется система, в которой все участки объема обладают одинаковым составом (химически однородная система) и свойствами (физически однородная систему). В противоположном случае система называется неоднородной. Неоднородная система может быть и гомогенной, если ее состав и свойства изменяются постепенно от одного участка объема к следующим без образования поверхности раздела между ними. Термином фаза обозначается совокупность всех гомогенных частей системы, одинаковых по составу и по всем физическим и химическим свойствам (не зависящим от количества вещества) и отграниченных от других частей системы некоторой поверхностью (поверхностью раздела). Так, в системе, состоящей из жидкой воды и льда, имеются две фазы — жидкая вода и лед (независимо от того, находится ли последний в виде одного куска или нескольких). Фазы, состоящие из одного какого-нибудь химически индивидуального вещества, называют простыми (их называют также чистыми): а фазы, содержащие два индивидуальных вещества или больше,— смешанными фазами. Любая гомогенная система представляет собой одну фазу. Гетерогенные же системы содержат не менее двух фаз. Изолированной системой называют такую систему, которая рассматривается как лишенная возможности обмена веществом или энергией с окружающей средой и имеющая постоянный объем. Последнее условие вызывается тем, что изменение объема всегда связано с производством работы (кроме случая, когда р = 0). Закры-той называют систему, которая лишена возможности обмена веществом с окружающей средой, но способна обмениваться с ней энергией и может не сохранять постоянным свой объем. Системы, свободные от этого ограничения, называют открытыми. Рассматривая то или другое из термодинамических свойств какой-нибудь системы и желая подчеркнуть это, можно называть ее термодинамической системой. Совокупность всех физических и химических свойств системы характеризует состояние ее. Изменение каких-нибудь из этих свойств означает изменение состояния системы. Принято называть общим термином термодинамический параметр состояния (или, кратко, параметр состояния) любую из величин, служащих для характеристики состояния термодинамической системы, — температуру, давление, объем, внутреннюю энергию, энтропию, концентрацию и др. Значение какого-нибудь параметра состояния для данных условий существования системы (если не рассматривать неустойчивых состояний) не зависит от тех состояний, в которых вещество находилось ранее. Всякое изменение, происходящее в системе и связанное с изменением хотя бы одного из термодинамических параметров состояния, называется термодинамическим процессом или, кратко, процессом. Термодинамическим параметром процесса (кратко параметром процесса) называется любая из термодинамических величин, служащая для характеристики процесса (изменение внутренней энергии, тепловой эффект реакции, теплота испарения и т. д.). Конечное изменение какого-нибудь параметра состояния х в процессе будем обозначать через ∆х, а бесконечно малое изменение его — через dх или ∆U=U2-U1 Процесс, при котором термодинамическая система, выйдя из некоторого начального состояния и претерпев ряд изменений, возвращается тем или другим путем в то же состояние, называется круговым процессом или циклом. Изменение параметра состояния не зависит, в частности, и от того, обратимым или необратимым путем был осуществлен этот переход. Очевидно, что в круговом процессе изменение любого параметра состояния равно нулю. Отнюдь не все термодинамические величины обладают таким свойством. Как мы увидим в дальнейшем, количество теплоты Q, выделяемой или поглощаемой системой, и количество работы А, совершаемой системой, зависит не только от начального и конечного состояний системы, но и от того, как происходил переход от одного состояния к другому. Бесконечно малые количества теплоты и работы мы будем обозначать соответственно через Процессы, происходящие при постоянной температуре, называются изотермическими или, иначе, изотермными, происходящие при постоянном давлении — изобарными, а происходящие при постоянном объеме — изохорными. Адиабатными называют процессы, при которых система не принимает и не отдает теплоты, хотя может быть связана с окружающей средой работой, получаемой от нее и совершаемой над ней. С другими видами процессов мы познакомимся позднее. Термином теплоприемник обозначается каждая из термодинамических систем, которым сообщает теплоту рассматриваемая система, и теплоотдатчиком — каждая из систем, от которых рассматриваемая система принимает теплоту. Обратимый термодинамический процесс определяют как процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. В противном случае процесс является необратимым. Следует подчеркнуть, что эта обратимость или необратимость процесса в термодинамическом смысле не совпадает с понятием об обратимости или необратимости химических реакций в химии, где термин «обратимый» нередко применяется к любым реакциям, которые могут осуществляться как в прямом, так и в обратном направлениях, хотя бы возвращение системы в исходное состояние было связано с теми или иными изменениями в окружающей среде. Термодинамический процесс, при котором система проходит через непрерывный ряд равновесных состояний, называют равновесным процессом. Такой процесс называют иногда квазистатическим. Для процессов, рассматриваемых в нашем курсе, обратимость и равновесность процесса совпадают, т. е. всякий обратимый процесс будет в то же время равновесным и, наоборот, всякий равновесный — обратимым. При таком процессе в каждый данный момент система находится в состоянии, бесконечно близком к равновесному, и достаточно бесконечно мало изменить условия, чтобы процесс мог быть обращен, т. е. мог протекать в противоположном направлении. Так как равновесный процесс всегда является процессом бесконечно медленным, то это показывает, что все практически используемые процессы лишь в той или иной степени могут приближаться к равновесным. Энергия, как известно, может существовать в различных видах, причем любой вид энергии является соответствующей формой движения материи. В химической термодинамике одну из важнейших величин представляет внутренняя энергия U рассматриваемой системы. Эта величина является параметром состояния. Термодинамически она строго определяется на основе первого закона. Физически же этим термином обозначается величина, которая характеризует общий запас энергии системы, включая сюда энергию поступательного и вращательного движения молекул, энергию внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергию вращения электронов в атомах, энергию, заключающуюся в ядрах атомов, и другие виды энергии, но без учета кинетической энергии тела в целом и его потенциальной энергии положения. Энергия системы, равная сумме ее внутренней энергии, кинетической энергии и потенциальной энергии, иногда называется полной энергией. В настоящее время пока не имеется возможности определить абсолютную величину внутренней энергии какой-нибудь системы, так как неизвестным остается значение U0 (при Т = ОК). Однако большей частью можно измерить изменение энергии ∆U, происходящее в том или ином процессе, что оказывается уже достаточным для успешного применения этого понятия в термодинамике. Величина ∆U считается положительной, когда в рассматриваемом процессе внутренняя энергия системы возрастает. Внутренняя энергия зависит, очевидно, как от вида и количества рассматриваемого вещества, так и от условий его существования. При одинаковых условиях для данного вещества количество внутренней энергии прямо пропорционально количеству вещества. Другой термодинамической функцией, широко используемой, является энтальпия Н. Она определяется простым соотношением: H=U + pv где р — давление; v — объем рассматриваемой системы. Энтальпию иначе называют теплосодержанием, однако этот термин может дать повод к неправильному пониманию физического смысла этой величины, создавая впечатление, что она характеризует «количество теплоты в теле». Определение ясно показывает, что это не так. Как и внутренняя энергия, энтальпия является функцией состояния, т. е. изменение ее всецело определяется заданными начальным и конечным состоянием системы и не зависит от промежуточных состояний. Принимается, что H0 = U0. При рассмотрении процессов, протекающих при постоянном объеме, удобнее пользоваться величиной изменения внутренней энергии, а энтальпия оказывается особенно ценной при рассмотрении изобарных процессов. Однако разница между этими величинами значительна главным образом для систем, содержащих вещества в газообразном состоянии, так как для газов при невысоких давлениях произведение pv то близко RТ, т. е. того же порядка, что и кинетическая энергия поступательного движения молекул. Для конденсированных же состояний разница между U и H относительно невелика и для веществ в кристаллическом состоянии в обычных условиях обычно не превышает примерно 5%. Энергия может передаваться от одной части системы к другой в форме теплоты или в форме работы. Теплота, как уже было указано, не является функцией состояния. Количество теплоты, выделяемой или поглощаемой при переходе рассматриваемой системы из состояния 1 в состояние 2, зависит от пути перехода. Так, изотермическое расширение идеальных газов не сопровождается выделением или поглощением теплоты, если процесс протекает без совершения газом работы. В противном же случае процесс сопровождается поглощением теплоты. Процессы, при которых теплота выделяется, называются экзотермическими, а процессы, при которых теплота поглощается, — эндотермическими. Количественно теплота может выражаться в любых единицах энергии и относиться к любым количествам вещества. Теплоте выделяемой системой, и теплоте, поглощаемой ею, всегда приписывают противоположные знаки. В термодинамике принято считать положительной теплоту q, поглощаемую системой в данном процессе, и отрицательной — теплоту, выделяемую системой. При такой системе знаков тепловым эффектом процесса называют сумму поглощаемой теплоты и всей работы, выполненной окружающей средой над данной системой, за вычетом работы внешнего давления. Очевидно, что все величины должны быть выражены в одинаковых единицах. В этой книге мы будем рассматривать тепловые эффекты только для процессов, происходящих при постоянной температуре и при постоянном объеме или давлении. Можно показать, что для изохорно-изотермических процессов тепловой эффект равен изменению внутренней энергии системы ∆U = U2 – U1, а для изобарно-изотермических он равен изменению энтальпии системы ∆H = H2 – H1 Мы будем преимущественно рассматривать изобарно-изотермические процессы. Эти соотношения показывают, что при постоянной температуре в изохорных процессах и в изобарных процессах тепловой эффект не зависит от пути перехода и однозначно определяется начальным и конечным состояниями системы. Нередко тепловые эффекты процессов называются и просто теплотой процесса (теплота образования, теплота сгорания, теплота испарения и т. п.). Теплотой плавления, испарения, сублимации, полиморфного превращения и других процессов называется теплота, поглощаемая при изотермических и обратимых процессах плавления, испарения, сублимации, полиморфного превращения, а также в процессах растворения и т. д. (раньше их часто называли скрытыми теплотами). Все энергетические величины (внутренняя энергия, энтальпия, тепловые эффекты, теплоты образования, теплоты плавления, испарения и др.) могут выражаться в любых энергетических единицах. Наиболее часто их принято выражать в джоулях или в калориях и относить обычно к одному молю вещества (мольные величины) или к количеству вещества, указанному в реакции. Теплоемкость тел. Различают среднюю теплоемкость системы с, относящуюся к изменению температуры на некоторую конечную величину и равную отношению количества сообщенной теплоты к соответствующему изменению температуры:
и истинную теплоемкость с, соответствующую бесконечно малому изменению температуры: с = В зависимости от характера процесса, т. е. от условий, в которых происходит изменение температуры тела, можно рассматривать различные виды теплоемкостей. Наиболее важную роль из них играют теплоемкость при постоянном объеме Сv, называемая изохорной теплоемкостью, и теплоемкость при постоянном давлении Ср, называемая изобарной теплоемкостью. Различают также и другие виды теплоемкостей, в частности, например, теплоемкость насыщенного пара, относящуюся к условиям одновременного изменения и температуры, и давления, меняющихся таким образом, чтобы пар все время оставался насыщенным. Теплоемкости выражают в джоулях или в калориях на градус на моль (мольная теплоемкость) или на грамм-атом (атомная теплоемкость). Температура является понятием достаточно известным. Более строго мы рассмотрим это понятие в позднее на основе второго закона термодинамики. Абсолютные значения многих термодинамических функций (внутренней энергии, энтальпии и др.) для какого-нибудь данного вещества в настоящее время неизвестны, но изменения этих функций при переходе вещества из одного состояния в другое часто могут быть определены. Это дает возможность характеризовать значение рассматриваемой функции в интересующем состоянии по сравнению со значением ее в другом состоянии. Сопоставляя значения функции для различных состояний данного вещества, рассматривают отличие их от значения, относящегося к одному определенному состоянию (стандартное состояние). Так, свойства компонентов в растворах различной концентрации сравнивают со свойствами тех же компонентов в чистом состоянии при той же температуре, свойства неидеальных газов часто сопоставляют со свойствами их в состоянии идеального газа при той же температуре и при этом же давлении (или при нормальном атмосферном давлении). Давление определяется как сила, действующая на единицу поверхности, и может быть выражено в различных единицах, отвечающих этой размерности. В системе СИ за единицу давления принят Паскаль, Па, равный 1 н/м2. Временно разрешено выражать давление также, в частности, в барах, в мм рт. ст., считая, что одна атмосфера соответствует 760 мм столба ртути, обладающей плотностью 13,5951 г/см3 (плотность при 0°С), при ускорении силы тяжести g = 980,665 см/с2. При этом всегда указывается абсолютное давление, а не разность его с внешним (атмосферным) давлением. Работа является одной из форм передачи энергии от системы, совершающей работу, к системе, над которой работа выполняется. При этом внутренняя энергия системы, совершающей работу, уменьшается, а энергия системы, подвергающейся воздействию, возрастает на величину, отвечающую произведенной работе (если одновременно не происходила передача теплоты). Работу мы будем обозначать буквой А, выражать в калориях (больших или малых) и считать положительной, если она совершается системой над окружающей средой или над другой системой. Широко применяется также обозначение работы буквой W В настоящее время ЮПАК принято решение рекомендовать в дальнейшем обозначение работы буквой W с обратным знаком, т. е. W = —А Работа любого вида определяется двумя величинами, одна из которых является фактором интенсивности, другая же — фактором емкости (иначе — экстенсивности или амплитуды). Если фактор интенсивности сохраняет в данном процессе постоянное значение, то работа равна произведению фактора интенсивности на изменение фактора емкости. Так, обычная механическая работа в этом случае равна произведению приложенной силы на расстояние; работа против электрических сил равна произведению разности потенциалов на количество электричества; работа против силы земного тяготения равна произведению силы mg (где m — масса тела, а g — ускорение силы тяжести) на высоту поднятия тела; работа расширения против внешнего давления равна произведению давления р на изменение объема ∆v. В этих примерах факторами интенсивности являются приложенная сила, разность потенциалов, сила тяжести, давление, а изменениями факторов емкости — расстояние, количество электричества, высота подъема, изменение объема. В термодинамическом смысле работа, совершаемая системой, всегда связана с действием против внешних сил. Из различных видов работы особое значение в термодинамике получила работа против внешнего давления. Поэтому на ее примере мы рассмотрим, как связывается работа с факторами интенсивности и емкости в более общем случае, когда фактор интенсивности в течение процесса не сохраняет постоянного значения.
|


 х (последнее — в частных производных). Термодинамические функции, значения которых зависят только от состояния системы, называются функциями состояния и их изменение в каком-нибудь процессе зависит только от начального и конечного состояний системы и не зависит от пути перехода. Для них ∆х = х2 — х1, где х1 — значение данного параметра в начале процесса и х2 — значение в конце. Например, изменение внутренней энергии ∆U системы при переходе последней из какого-нибудь состояния 1 в другое состояние 2 всегда определяется равенством:
х (последнее — в частных производных). Термодинамические функции, значения которых зависят только от состояния системы, называются функциями состояния и их изменение в каком-нибудь процессе зависит только от начального и конечного состояний системы и не зависит от пути перехода. Для них ∆х = х2 — х1, где х1 — значение данного параметра в начале процесса и х2 — значение в конце. Например, изменение внутренней энергии ∆U системы при переходе последней из какого-нибудь состояния 1 в другое состояние 2 всегда определяется равенством: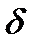 Q и
Q и 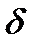 А (знак дифференциала а в этих случаях применять не следует).
А (знак дифференциала а в этих случаях применять не следует). =
=