Гидролиз солейТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ Курс лекций для студентов химико-технологических специальностей
Часть II «Основные типы химических реакций»
МОГИЛЁВ 2006 УДК 541 ББК 24.1
Рассмотрен и рекомендован к изданию на заседании кафедры химии. Протокол № 7 от 21 декабря 2005 г.
Составитель В. В. Ясинецкий
Рецензенты: кандидат химических наук, доцент УО БГПУ А. С. Тихонов кандидат химических наук, доцент УО МГУП Н. И. Сухарева
Ясинецкий В. В. Теоретические основы химии: Курс лекций для студентов химико-технологических специальностей. Часть II. – Могилев: УО МГУП, 2006. – 87 с.
ISBN
УДК 541 ББК 24.1 Ó УО «Могилевский государственный ISBN университет продовольствия», 2006
Содержание Гидролиз солей…………………………………………………………………2 8 Гетерогенные равновесия в растворах электролитов………………………17 9 Комплексные соединения…………………………………………………….26 10 Ионно-молекулярные (обменные) реакции в растворах электролитов…..38 11 Окислительно-восстановительные свойства веществ. Окислительно-восстановительные реакции………………………………..50 12 Электрохимические реакции………………………………………………...65 13 Коррозия металлов…………………………………………………………...74 14 Электролиз…………………………………………………………………....80 15 Химические источники электрического тока………………………………86 Гидролиз солей Гидролиз – это частный случай обменных реакций, в которых реальные или потенциальные ионы растворенного вещества заменяются на ионы воды. Обменные реакции, в которых в которых составные части растворенного вещества связываются с ионами воды, образуя слабые кислоты и (или) слабые основания, называют реакциями гидролиза.
Как и другие реакции обмена, гидролиз возможен в случае, если его продуктами оказываются слабые электролиты (или неэлектролиты), а также малорастворимые продукты (твердые или газообразные). Гидролизу подвергаются многие вещества, как органические, так и неорганические: соли, галогенангидриды, эфиры, жиры и др. При растворении солей в воде большинство их под влиянием молекул растворителя полностью диссоциируют на катионы и анионы: KatxAy Вода – один из слабейших неорганических электролитов – хотя и в малой степени, но также диссоциирует на ионы, при этом одновременно с реакцией диссоциации протекает обратная реакция – ассоциация ионов H+ и OH– с образованием молекул воды: HOH В чистой воде молярные концентрации ее ионов одинаковы, поэтому pH = 7 (см. тему «Диссоциация электролитов»). Если в растворе появляются ионы соли, то баланс между ионами H+ и OH– может нарушиться. Так, если катионам соли соответствует слабое основание, то они могут конкурировать с ионами водорода за связывание гидроксид-ионов, в результате чего ионы H+ окажутся в избытке, и раствор будет подкисляться: Katy+ + H–OH Если анионам соли соответствует слабая кислота, то они могут конкурировать с гидроксид-ионами за связывание ионов водорода, в результате чего ионы OH– окажутся в избытке, раствор будет подщелачиваться: Ax– + H–OH
Таким образом, из солей гидролизуются те, в состав которых входят катионы слабого основания и (или) анионы слабой кислоты. Чем слабее электролит, образующийся при гидролизе, тем более полно протекает гидролиз.
Если заряды (x, y) гидролизующихся ионов соли больше единицы, то такие реакции протекают в несколько стадий (ступеней). Например, катионы алюминия, связывая гидроксид-ионы воды, могут образовать гидроксоалюминат –, дигидроксоалюминат – катионы и молекулы гидроксида: Al3+ + HOH AlOH2+ + HOH Al(OH)2+ + HOH Сульфид-ионы могут связывать ионы водорода, образуя гидросульфид – ионы и молекулы сероводорода: S2– + HOH HS– + HOH Уравнения реакций гидролиза При написании ионных и молекулярных реакций гидролиза рекомендуется следующая последовательность их составления: а) написать уравнение диссоциации соли и выделить ионы, способные участвовать в гидролизе; б) написать уравнение реакции этих ионов с молекулами воды (сокращенное ионно-молекулярное уравнение гидролиза); в) добавить в уравнение (б) ионы соли, не участвующие в гидролизе (получится полное ионно-молекулярное уравнение); г) соединить катионы и анионы в левой и правой частях уравнения (в) с образованием соответствующих электролитов (получится молекулярное уравнение гидролиза).
Примеры: Гидролиз солей слабых оснований: – соли образованные однозарядным катионом слабого основания:
NH4NO3 (выделены ионы слабого основания, NH4 +) NH 4+ + H OH
NH4+ + NO 3 – + HOH
NH4NO3 + H2O гидролиза
– соли образованные многозарядным катионом слабого основания и однозарядным анионом сильной кислоты (CuCl2, Al(NO3)3 и др.): CuCl2 слабого основания, Cu 2+) В гидролизе участвуют многозарядные катионы Cu2+, поэтому реакция протекает ступенчато. Первая ступень: Cu 2+ + H OH Cu2+ + 2Cl – + HOH CuCl2 + H2O Вторая ступень: CuOH + + H OH CuOH+ + Cl – + HOH (CuOH)Cl + H2O Внимание: Иногда уравнения ступенчатого гидролиза объединяют в одно «общее уравнение»: CuCl2 + H2O Делать это не следует, т.к. такое «уравнение» не отражает ни фактическое соотношение реагентов, ни качественный состав продуктов (об этом говорилось и ранее, см. «ступенчатую диссоциацию электролитов»).
– соли, образованные многозарядным катионом слабого основания и многозарядным анионом сильной кислоты (CoSO4, Cr2(SO4)3 и др.). Если в состав соли, гидролизующейся соли входят многозарядные ионыто при переходе от полного ионно-молекулярного уравнения к молекулярному может понадобиться дополнительная операция – введение множителя: а) CoSO4 (выделены ионы слабого основания, Co2+) Первая ступень гидролиза: Co 2+ + H OH Co2+ + SO 42 – + HOH В отличие от примера 2 в правой части полученного уравнения – один сульфат-ион на два разных катиона, CoOH+и H+. В подобных случаях необходимо удвоить все коэффициенты в полном ионно-молекулярном уравнении: 2 Co2+ + 2 SO42– + 2 HOH Соединив катионы с анионами, получим молекулярное уравнение: 2CoSO4 + 2H2O Вторая ступень гидролиза: В гидролизе по второй ступени участвуют ионы CoOH+ – продукт первой ступени гидролиза: CoOH + + H OH уравнение При написании полного ионно-молекулярного уравнения учтем, что в состав (CoOH)2SO4 входят два катиона CoOH+, потому полученное сокращенное ионно – молекулярное уравнение сначала удвоим: 2CoOH+ + 2HOH 2CoOH+ + SO 42 – + 2HOH Соединив катионы с анионами, получим молекулярное уравнение: (CoOH)2SO42– + 2HOH Если в состав соли входят не один, а несколько катионов (или анионов), участвующих в гидролизе, то сокращенное ионно-молекулярное уравнение пишут сначала для одного иона, а затем полученное уравнение умножают на соответствующий коэффициент.
б) Cr2(SO4)3 Первая ступень гидролиза: Cr 3+ + H OH Учитывая, что в состав соли входят два катиона хрома, умножим на два левую и правую части полученного равнения: 2Cr3+ + 2HOH
В соответствии с уравнением диссоциации добавив в левую и правую части соответствующее число сульфат-ионов, по три, получим полное ионно-молекулярное уравнение: 2Cr3+ + 3SO 42– + 2HOH
Соединив катионы с анионами, получим молекулярное уравнение: Cr2(SO4)3 + 2H2O
Вторая ступень: CrOH 2+ + H OH молекулярное уравнение, 2 CrOH2+ + 2 HOH 2CrOH2+ + 2SO4 2– + 2HOH молекулярное уравнение, 2Cr(OH)SO4 + 2H2O
Третья ступень: Cr(OH) 2+ + H OH молекулярное уравнение, 2 Cr(OH)2++ 2 HOH 2Cr(OH)2++ SO 42– + 2HOH молекулярное уравнение [Cr(OH)2]2SO4 + 2H2O Гидролиз солей слабых кислот: – соли, образованные однозарядными анионами слабых кислот (KF, Ca(NO2)2 и др.):
KF F – + H OH F– + K+ + HOH KF + H2O
– соли, образованные многозарядными анионами слабых кислот: (K2S, Na2CO3 и др.): K2S Анионы многозарядные, поэтому гидролиз протекает ступенчато. Первая ступень: S 2– + H OH уравнение (выделен анион слабой кислоты); 2K + + S2– + HOH K2S + H2O Вторая ступень: HS –+ H OH уравнение K + + HS–+ HOH KHS + H2O Гидролиз солей слабых оснований и слабых кислот Если в состав соли входят катионы слабого основания и анионы слабой кислоты (NH4F, NH4CN и др.) то в реакции с водой участвуют и те, и другие: катионы соли связываются с гидроксид – ионами, а анионы – с ионами водорода. Однако в большинстве случаев баланс ионов воды при этом в растворе не сохраняется, т.к. образующиеся основание и кислота по силе, как правило, разные. В результате таких реакций раствор становится кислым, если образующаяся кислота сильнее, чем основание, и щелочным, если наоборот:
а) NH4F уравнение гидролиза по катиону NH 4+ + H OH уравнение реакции по аниону F – + H OH сложив оба уравнения, получим NH4+ + F– + HOH объединив катионы с анионами в левой части, получим NH4F + H2O Для определения реакции среды, сравним константы диссоциации KHF= 6×10–4 и KNH3*H2O = 1,8×10–5. Вследствие того, что константа кислоты больше, чем основания, раствор будет кислым (pH < 7). Необратимый (полный) гидролиз Если катиону соли соответствует слабое малорастворимое основание, а аниону – слабая малорастворимая кислота, то такие соли гидролизуются полностью, необратимо; в водных растворах они не существуют и не образуются (сульфиды алюминия, хрома(III), их карбонаты и др.) Например, сульфид алюминия можно получить сплавлением алюминия с серой, но при растворении в воде он полностью гидролизуется, при этом выделяются малорастворимые Al(OH)3 – осадок и H2S – газ: Al2S3 + 6HOH Необратимый гидролиз протекает и в тех случаях, когда соответствующие катионы и анионы оказались в растворе не из одной соли, а из разных. Например, при смешении растворов хлорида алюминия и сульфида натрия результат будет аналогичным рассмотренному выше, т.к. в растворе оказались одновременно те же ионы, Al3+ и S2–: Al Cl3 + Na2 S + HOH
Коэффициенты в подобных уравнениях расставляются на основании того, что заряд гидролизующегося катиона становится множителем перед гидролизующимся анионом и наоборот. Вследствие того, что сульфид-анион двухзарядный, перед Al Cl3 и Al(OH)3 ставим коэффициент «2»; вследствие того, что катион алюминия трехзарядный, перед Na2S и H2S ставим коэффициент «3»: 2 AlCl3 + 3 Na2S + HOH
Далее, для образования двух Al(OH)3 требуется шесть гидроксид-ионов, также как шесть ионов H+ требуется для образования трех H2S; очевидно для этого потребуется шесть H2O: 2AlCl3 + 3Na2S + 6 HOH
Осталось добавить в правую часть по шесть ионов Na+ и Cl–, в виде шести NaCl: 2AlCl3 + 3Na2S + 6H2O уравнение 2Al3+ + 3S2– + 6H2O Специфически протекает необратимый гидролиз метасолей амфотерных металлов, таких как NaAlO2, Na2ZnO2 и др. – при их гидролизе образуются гидроксокомплексы:
NaAlO2 + 2H2O AlO2– + 2H2O Гидролиз протекает вследствие того, что из слабого электролита – воды образуется еще более слабый – гидроксид-ионы. Гидролиз кислых солей Кислые соли (NaHCO3, NaH2PO4, KH2PO3, KHSO3, KHS и т.д.) образуют слабые многоосновные кислоты. Вследствие того, что в состав этих солей входят анионы слабых кислот, эти соли гидролизуются, подобно рассмотренным ранее солям слабых кислот. Например, раствор NaH2PO4 подщелачивается за счет гидролиза дигидрофосфат-ионов: NaH2PO4 H2PO4– + HOH В то же время, часть ионов H2PO4– не гидролизуется, а диссоциирует, в результате чего раствор подкисляется: H2PO4– Очевидно, что реакция раствора, кислая или щелочная, зависит от того, какое равновесие преобладает, гидролиз или диссоциация: если преобладает гидролиз, то раствор будет щелочным, если диссоциация – кислым. Диссоциацию электролита количественно характеризует константа диссоциации; равновесие гидролиза, по-видимому, – константа гидролиза, о чем мы пока не говорили. Поэтому к вопросу о pH в растворах кислых солей вернемся чуть позже.
Применение закона действующих масс к равновесию гидролиза. Константа гидролиза. Константа гидролиза количественно характеризует глубину протекания реакции: чем сильнее гидролизуется соль, тем больше константа гидролиза. Степень гидролиза также является его количественной характеристикой, но в отличие от константы, зависящей только от природы соли и температуры, степень гидролиза зависит еще и от ее концентрации. а) гидролиз с участием однозарядных катионов слабых оснований или анионов слабых кислот: NH4NO3 соль гидролизуется по катиону NH4+ + HOH Применив закон действующих масс к равновесию гидролиза, получим следующее уравнение: Kгидр. = Сделав в полученном уравнении подстановку [H+] = Kгидр. =
Из уравнения (7.1) видно, что константа гидролиза соли слабого однокислотного основания равна отношению ионного произведения воды к константе диссоциации основания. – Чем слабее основание, тем меньше его константа диссоциации, тем сильнее гидролизуется его соль. KF соль гидролизуется по аниону: F– + HOH Применив закон действующих масс к этому равновесию, получим следующее уравнение: Kгидр. = Kгидр. =
Из уравнения (7.2) видно, что константа гидролиза соли слабой одноосновной кислоты равна отношению ионного произведения воды к константе диссоциации этой кислоты. – Чем слабее кислота, тем меньше ее константа диссоциации, тем сильнее гидролизуется ее соль.
NH4F соль гидролизуется и по катиону, и по аниону: NH4+ + F– + HOH Применив закон действующих масс к этому равновесию, получим следующее уравнение: Kгидр. = Kгидр. =
Из уравнения (7.3) видно, что константа гидролиза соли слабого однокислотного основания и слабой одноосновной кислоты равна отношению ионного произведения воды к произведению констант диссоциации основания и кислоты.
б) гидролиз с участием многозарядных катионов слабых оснований или анионов слабых кислот (K2CO3, ZnCl2, (NH4)2S и др.):
K2CO3 Первая ступень гидролиза: CO32– + HOH Kгидр. = Kгидр. =
ZnCl2 Первая ступень гидролиза: Zn2+ + HOH
Kгидр. =
Kгидр. =
K4[Zn(OH)4]2– в уравнении (7.5) – это четвертая (последняя) константа ступенчатой диссоциации тетрагидроксоцинкат-иона.
(NH4)2S Первая ступень гидролиза: NH4+ + HOH S2– + HOH __________________________________________________ NH4+ + S2– + 2HOH
Сократив по H2O в левой и правой частях уравнения, запишем для него выражение константы равновесия: Kгидр = Умножив числитель полученного уравнения на KW, а знаменатель – на равноценное [H+] [OH–], получим:
Kгидр = =
Из величины Кгидр. следует, что сульфид аммония по первой ступени гидролизуется практически полностью, и по этой причине в водном растворе не существует и не образуется.
Если сопоставить уравнения (7.1) – (7.6), то станет очевидным, что константа гидролиза рассчитывается делением ионного произведения воды на константу диссоциации электролита, образующегося пригидролизе (или на произведение соответствующих констант, если соль гидролизуется и по катиону и по аниону).
Покажем, как применить это правило для расчета константы гидролиза гидрофосфата натрия:
Na2HPO4 HPO42– + HOH Продуктом гидролиза гидрофосфат-ионов оказались дигидрофосфат-ионы – на их константу диссоциации и следует разделить ионное произведение воды: Кгидр.= В знаменателе дроби – H3PO4 H2PO4– HPO42–
Очевидно, что диссоциации H2PO4–соответствует вторая константа диссоциации ортофосфорной кислоты, поэтому на нее и следует разделить KWприрасчете константы гидролиза: Кгидр.= Какую реакцию имеет раствор этой соли? Ясно, что за счет гидролиза этой соли раствор подщелачивается (см. ионное уравнение). В то же время гидрофосфат-ионы могут участвовать и в другом равновесии – диссоциации по кислотному типу: HPO42– За счет этой реакции раствор подкисляется. Для того чтобы определить результат этих конкурирующих равновесий необходимо сравнить их константы, Кгидр = Расчет материального баланса равновесия гидролиза. Степень гидролиза. Степень гидролиза (h) показывает, какая часть растворенной соли прогидролизовалась: h = где сгидр. – концентрация, прогидролизовавшейся соли, с0 – начальная ее концентрация, моль/л. В уравнении (7.7) вместо молярности может быть химическое количество вещества или число частиц.
Связь степени гидролиза с константой гидролиза выводится подобно тому, как это было показано ранее для степени диссоциации слабых электролитов Например, для расчета степени гидролиза соли слабой одноосновной кислоты KNO2 в растворе с концентрацией с0 моль/л: – Напишем сокращенное ионно-молекулярное уравнение гидролиза и рассчитаем Кгидр.: KNO2
NO2– + HOH
Kгидр. = Из уравнения (7.7): сгидр. = с0×h; из ионного уравнения гидролиза видно, что сгидр. = [HNO2] = [OH–] = с0×h Подставив эти соотношения в выражение константы гидролиза, получим следующее уравнение:
Kгидр. = Решая полученное уравнение относительно h, определим затем [HNO2] = [OH–] = С0×h, а также [HNO2] = (C0 – С0×h), моль/л. Уравнение (7.8) можно упростить: если h << 1 (при Kгидр./с0
Таким образом, степень гидролиза зависит от природы соли (через Kгидр) и обратно пропорциональна корню квадратному из молярной ее концентрации.
Если необходимо определить только равновесные концентрации продуктов гидролиза, без степени гидролиза, то расчет можно выполнить общим способом материального баланса в равновесной системе: Обозначим: концентрацию прогидролизовавшейся соли сгидр. = х моль/л; равновесную (негидролизованную) часть соли (с0 – x), моль/л; равновесную концентрацию продуктов гидролиза [HNO2] = [OH–] = сгидр. = x. моль/л; Подставив эти соотношения в выражение константы гидролиза, получим следующее уравнение: Kгидр. = Решая полученное уравнение относительно x, определим [HNO2] = [OH–] = x, а также [HNO2] = (с0 – x), моль/л. Если h << 1 (при Kгидр./с0 х = [OH–] = [HNO2] = Пример: Рассчитать степень гидролиза и pH в растворе нитрита калия при C0(KNO2) = 0,1 моль/л. Решение: Уравнение диссоциации соли KNO2 Уравнение гидролиза NO2– + HOH
Kгидр. =
Проверим возможность использования упрощенного расчета:
[HNO2] = [OH–] = pOH = 6,89; pH = 7,11 Смещение равновесий гидролиза (усиление и подавление гидролиза), влияние pH В соответствии с принципом Ле Шателье равновесие гидролиза, например NO2– + HOH Гидролиз – процесс в большинстве случаев эндотермический, поэтому при увеличении температуры равновесие смещается вправо (степень гидролиза и концентрация продуктов в растворе увеличиваются); при охлаждении раствора равновесие смещается в обратном направлении. Для некоторых солей этот способ смещения равновесия отчетливо проявляется опытным путем: так, при кипячении раствора хлорида железа(III) из него выделяется осадок гидроксида. При увеличении концентрации соли равновесие смещается в прямом направлении (концентрация продуктов увеличивается, но степень гидролиза уменьшается – см.
|

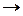 xKaty+ + yAx–
xKaty+ + yAx–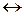 H+ + OH–
H+ + OH– + 3H2S
+ 3H2S 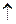 .
.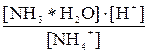 ; обратите внимание, что в знаменатель не включена [H2O] – реагента в большом избытке (см. тему «Константа химического равновесия»).
; обратите внимание, что в знаменатель не включена [H2O] – реагента в большом избытке (см. тему «Константа химического равновесия»). , получим следующее уравнение: Kгидр. =
, получим следующее уравнение: Kгидр. =  или
или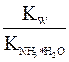 =
=  (7.1)
(7.1)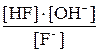 ; после подстановки [OH–] =
; после подстановки [OH–] =  получим
получим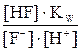 или
или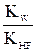 =
= 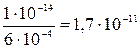 (7.2)
(7.2) 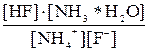 ; после умножения числителя дроби на KW, а знаменателя – на равноценную величину [H+]
; после умножения числителя дроби на KW, а знаменателя – на равноценную величину [H+] 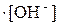 , получим
, получим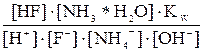 или
или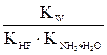 =
= 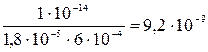 (7.3)
(7.3) 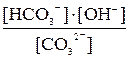 ; умножив числитель и знаменатель на [H+], получим:
; умножив числитель и знаменатель на [H+], получим: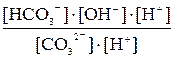 =
= 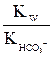 =
=  (7.4)
(7.4)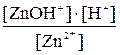 ; умножив числитель и знаменатель на [OH–], получим:
; умножив числитель и знаменатель на [OH–], получим:
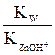 =
= 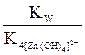 ; (7.5)
; (7.5) H2O + H+
H2O + H+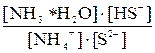
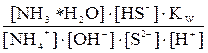 =
=  = (7.6)
= (7.6) = 5,6
= 5,6 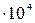
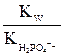
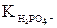 – это одна из констант диссоциации ортофосфорной кислоты, – какая из трех? Напишем уравнения ступенчатой диссоциации ортофосфорной кислоты, соответствующие им константы и определим, какая из них должна быть в знаменателе полученной дроби:
– это одна из констант диссоциации ортофосфорной кислоты, – какая из трех? Напишем уравнения ступенчатой диссоциации ортофосфорной кислоты, соответствующие им константы и определим, какая из них должна быть в знаменателе полученной дроби: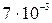


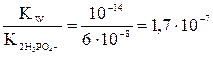
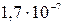 и K3 =
и K3 = 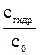 , (7.7)
, (7.7) (см. тему 6).
(см. тему 6).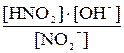 =
= 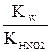
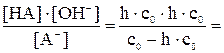
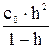 (7.8)
(7.8) 10–2), то можно считать, что (1 – h)» 1; тогда Kгидр. = с0 h2, и
10–2), то можно считать, что (1 – h)» 1; тогда Kгидр. = с0 h2, и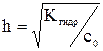 .=
.= 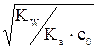 (7.8–а)
(7.8–а)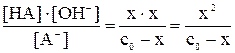
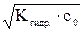 =
= 
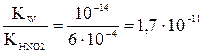
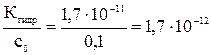 < 10–2 – упрощенный расчет возможен:
< 10–2 – упрощенный расчет возможен: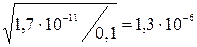
 h = 0,1×1,3×10–6 = 1,3×10–7 моль/л.
h = 0,1×1,3×10–6 = 1,3×10–7 моль/л.


