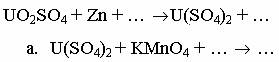Соединение с другими элементамиСкандий и его аналоги образуют с бором, углеродом, кремнием, азотом, фосфором, серой тугоплавкие соединения, часто с металлическими свойствами, например LaB6, ScN, LaC2, Sc5Si3, Sc3Si5, ScSi2, YB2. Многие из них нестехиометрического состава. Сульфиды металлов группы III В Э2S3 образуются при взаимодействии этих металлов с серой или сульфатов Э2(SO4)3 с углеродом при нагревании. Нитриды ЭN образуются при взаимодействии металлов, гидридов карбидов или оксидов этих металлов с азотом (иногда при сильном нагревании). Нитриды иттрия и лантана разлагаются водой: ЭN + 3Н2О = Э(ОН)3 + NН3 Карбид лантана LaC2 получают как и другие карбиды взаимодействием La2О3 с углеродом при высокой температуре. Он легко разлагается водой с образованием La(ОН)3, Н2, C2Н2 и других углеводородов.
2.4. Гидроксиды и их производные Студнеобразные белые осадки гидроксидов Э(ОН)3 образуются при обработке солей Э3+ растворами щелочей или аммиака. При нагревании они постепенно теряют воду и превращаются в оксиды:
От Sc(OH)3 к Ac(OH)3 усиливаются основные свойства. Так, Sc(OH)3 амфотерен, а La(OH)3 – довольно сильное основание. Sc(OH)3 + 3NаОН = Nа3 [Sc(OH)6] 2Sc(OH)3 + 3Н2SО4 = Sc(SО4)3 + 6Н2О Подобно алюминию, скандий и его аналоги образуют двойные соли, чем объясняется растворение карбонатов элементов группы III В в насыщенных растворах карбонатов щелочных металлов и аммония: La2 (СО3)3 + К2СО3 = 2К[La(СО3)2] На рис. 7 приведена схема взаимосвязи между основными типами соединений элементов группы III В на примере Sc. 2.5. Лантаноиды Лантаноиды – типичные металлы. Т.к. у элементов этого семейства происходит заполнение электронами третьей снаружи оболочки (4f - подуровня), а строение внешних оболочек остается неизменным, то лантаноиды очень близки по химическим свойствам. Поэтому выделение их из природных смесей сопряжено с определенными трудностями. В настоящее время это осуществляется с помощью ионообменных методов. Лантаноиды проявляют устойчивую степень окисления в соединениях +3, а некоторые из них также +2 и +4. Лантаноиды весьма реакционноспособны: легко окисляются на воздухе (Э2О3), реагируют с водородом (ЭН2, ЭН3), углеродом (Э2С3, ЭС2), серой (ЭS, Э2S3), кремнием (ЭSi2), фосфором (ЭР, ЭР2), галогенами (ЭГ) и другими неметаллами при повышенных температурах. Все лантаноиды реагируют с водой и кислотами (кроме НF и Н3РО4): 2Се + 6Н2О(гор.) = 2Се(ОН)3 + 3Н2
Рис. 7. Взаимопревращения основных соединений скандия
2Се + 6НCl = 2СеCl 3 + 3Н2 Се + 4НNO3 (разб.) = Се(NO3)3 + NO + 2Н2О Взаимосвязь между основными типами соединений на примере церия показана на рис. 8.
2.6. Актиноиды Все актиноиды радиоактивны. Торий, протактиний и уран встречаются в природе и поэтому могут быть получены из их соединений электролизом расплавов или методом металлотермии: UF4 + 2Ca = 2Ca F2 + U Остальные актиноиды получаются с помощью различных ядерных превращений. Актиноиды способны проявлять в соединениях степени окисления от +3 до +7, что обусловлено легкостью перехода электронов с 5f на 6d – подуровень. Актиноиды химически активны. На воздухе они быстро окисляются кислородом (ЭО2) и азотом (ЭN, Э2N3, Э3N4, ЭN2), взаимодействуют с водородом (ЭН2, ЭН3, ЭН4), фосфором (ЭР, Э3Р4), серой (ЭS, Э2S3, ЭS2), углеродом (ЭС, Э2С3, ЭС2), галогенами (ЭГ3, ЭГ4, ЭГ5, ЭГ6). Со щелочами при обычных условиях не взаимодействуют; довольно легко окисляются водой и кислотами: Th + 4Н2О(пар) = Th(ОН)4 + 2Н2 Th + 4НCl = ThCl4 + 2Н2 3Th + 4НNO3 + 12HCl = 3ThCl4 + 4NO + 8Н2O На рис. 9 показана схема взаимосвязи между основными типами соединений на примере урана.
Рис. 8. Взаимопревращения основных соединений церия
Рис. 9. Взаимопревращение основных соединений урана
2.7. Применение Применение скандия ограниченно из-за его дороговизны. В силу своей теплостойкости, легкости, высокой прочности и химической стойкости скандий является перспективным материалом для авиа- и ракетостроения. Sc используется в электровакуумной технике как геттер (поглотитель газов). Металлы подгруппы скандия используются в качестве добавок к сплавам. Оксиды этих элементов применяются в качестве катализаторов в производстве огнеупорной керамики, ферритов, лазерных материалов. Оксиды иттрия и лантана используются в производстве высокотемпературных сверхпроводящих материалов. Основная область применения лантаноидов – металлургия, где они используются как добавки к различным сплавам. Оксиды этих элементов применяются в качестве катализаторов, входят в состав многих лазерных и ферромагнитных материалов, используются в оптической промышленности. Актиноиды и их соединения применяются в основном в атомной энергетике. 3. КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО ТЕМЕ «СВОЙСТВА ЭЛЕМЕНТОВ III ГРУППЫ»
Вариант 1 1.Напишите уравнения реакций, позволяющих получить алюминий и серу из сульфата алюминия. 2.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Вариант 2
1.Какой объем 40 % раствора гидроксида калия 2.Напишите уравнения реакций (в молекулярной и ионной формах) получения гидроксидов скандия, иттрия и лантана. Как изменяется сила оснований в этом ряду? Вариант 3 1.Для полного перевода в раствор сплава Al+Cu+Mg следует использовать разбавленный раствор кислоты: а) HCl; б) H2SO4; в) HNO3; г) CH3COOH. Выберите кислоту, напишите уравнения реакций. 2.Гидроксид скандия получают осаждением из растворов солей скандия тиосульфатом натрия:
Какова масса полученного гидроксида скандия (III), если в результате реакции выделилось 84 л оксида серы (IV) (н.у.)?
Вариант 4 1. Составьте уравнения реакций, протекающих по схеме:
2.Окислительно – восстановительный потенциал сопряженной пары
Вариант 5 1.Напишите уравнения реакций, при помощи которых можно осуществить следующие переходы:
Назовите все указанные соединения таллия. 2.Имея в распоряжении сульфат алюминия и уголь, получите карбид алюминия. Вариант 6 1.Составьте уравнения реакций, отвечающих схеме
2.Оксид лантана массой 25 г «погасили» водой. После длительного стояния на воздухе первоначально образовавшийся слизистый белый осадок превратился в плотный осадок карбоната лантана. Вычислите его массу.
Вариант 7 1.Какой объем 15,5% раствора азотной кислоты 2.Имея в распоряжении нитрид алюминия, воду и хлор, получите хлорид алюминия. Вариант 8 1. Какие последовательные изменения претерпевает борная кислота при нагревании? Что образуется при нейтрализации борной кислоты: а) эквивалентным количеством щелочи; б) избытком щелочи? 2. В 0,1 н. растворе степень гидролиза хлорида скандия (III) равна 9 %, хлорида натрия (III) – 0,01 %, хлорида лантана – 0,003 %. Какой из гидроксидов: скандия иттрия или лантана обладает более сильными основными свойствами?
Вариант 9 1.К осадку гидроксида алюминия добавляют водный раствор гидроксида натрия. Наблюдают растворение осадка, который выпадает снова при насыщении образовавшегося раствора диоксидом серы. Напишите уравнения реакций. 2.Образец газообразного борана ВхНу массой 1,11 г создает в сосуде объемом 0,8 л давление 6,66∙104 Па при 100 0С. Определите формулу борана.
Вариант 10 1.Сульфат церия (III) окисляется в щелочной среде кислородом воздуха в гидроксид церия (VI). Как ведет себя полученный гидроксид по отношению к концентрированной соляной кислоте? 2.Рассчитайте суммарную массу осадков в реакции взаимодействия сульфата алюминия с гидроксидом бария, если взято по 100 мл 0,15 м растворов обоих реагентов. Вариант 11 1.Растворимость сульфата алюминия 36,4 г/100г Н2О, сульфата калия – 11,1г/100г Н2О. Какие массы насыщенных растворов этих веществ надо смешать, чтобы путем выпаривания получить 237 г алюмокалиевых квасцов KAl (SO4)2∙12 Н2О? 2.Диоксид урана взаимодействует с концентрированной H2SO4 c образованием сульфата урана (IV), а в концентрированной HNO3 и царской водке окисляется, образуя соли диоксоурана (IV), т.е. соответственно нитрат и хлорид. Напишите уравнения реакций.
Вариант 12 1. К раствору, содержащему 35,24 г хлорида галлия (III) прилили раствор, содержащий 22 г сульфида калия. Определите массу образовавшегося осадка. 2. Скандий и его аналоги предельно понижают степень окисления азота в очень разбавленной азотной кислоте. Напишите уравнения реакций в ионно-молекулярной и молекулярной формах.
Вариант 13 1. Составьте уравнения реакций, протекающих по схеме:
2. Газообразный хлорид бора объемом 0,102 л (н.у.) подвергают полному гидролизу. Образовавшийся осадок отфильтровывают, а фильтрат разбавляют водой до 6 л. Определите рН конечного раствора.
Вариант 14 1. Сопоставьте, не производя вычислений, степень гидролиза: а) Ce(SO4)2 и Ce(SO4)3; б) хлоридов церия (III) и лютеция (III). 2. Составьте уравнения реакций, протекающих по схеме:
Вариант 15 1. Сульфат диоксоурана (VI) восстанавливается цинком с образованием соли урана (IV); последняя при действии сильных окислителей вновь образует сульфат диоксоурана (VI). Закончите уравнения реакций:
2. Напишите уравнения реакций, протекающих при постепенном добавлении раствора гидроксида натрия к раствору сульфата галлия.
Вариант 16 1. Рассчитайте массы продуктов, полученных при электролизе 2,5 л раствора хлорида алюминия с массовой долей AlCl3 15 % 2. Оксид скандия при сплавлении со щелочами образует скандиаты. Напишите уравнение реакций. Сходство, с какими оксидами проявляет при этом оксид скандия? Вариант 17 1. Почему алюминий растворяется в концентрированных Na2CO3 и NH4Cl? Приведите уравнения реакций. 2. Рассчитайте объем газа, образующегося при взаимодействии 89,16 г гидрида лантана с водой.
Вариант 18 1. Осуществите следующие превращения:
2. К раствору хлорида лантана (III) с нормальной концентрацией 0,5 моль/л добавили избыток оксалата калия. Определите массу образующегося малорастворимого декагидрата оксалата лантана (III). Вариант 19 1. Вычислите нормальность соляной кислоты, если на реакцию с 0,19 г Na2B4O7∙10H2O израсходовано 0,02 л раствора HCl. 2. Как и почему меняется основный характер гидроксидов при переходе от скандия к лантану и от лантана к лютецию?
Вариант 20 1. Что получится при взаимодействии фосфида алюминия: а) с водой; б) с H2SO4; в) с NaOH? 2. Фторид бора получают нагреванием оксида бора с фторидом кальция и концентрированной серной кислотой. Напишите уравнение реакций. 4. ХИМИЯ Р– ЭЛЕМЕНТОВ IVГРУППЫ Главную подгруппу IV группы составляют элементы C, Si, Ge, Sn, Pb. Электронная конфигурация внешнего уровня их атомов ns2np2. В соединениях проявляют положительные степени окисления +2 и +4, а С и Si также и отрицательные. С и Si – неметаллы, Ge, Sn и Pb – амфотерные элементы, металлические свойства которых возрастают с увеличением порядкового номера. В природе углерод встречается в виде четырех аллотропических модификаций: алмаза, графита, карбина и фуллеренов. Уникальным свойством фуллеренов является их способность размещать внутри своей кристаллической решетки атомы различных элементов. Это открывает большие перспективы использованияфуллеренов для создания новых магнитных носителей информации со сверхвысокой плотностью записи, аккумуляторов высокой емкости, в медицине. Важнейшие данные о р – элементах IV группы приведены в таблицах 7-9.
4.1. Способы получения Углерод в форме древесного угля может быть получен при нагревании древесины без доступа воздуха, при обугливании животных останков, неполном сгорании органических соединений (сажа). Графит получают из смеси кокса и каменно - угольной смолы, алмаз – из графита при очень высоком давлении и температуре, а карбин – каталитическим окислением ацетилена. Фуллерены получают испарением графита в электрической дуге в вакууме. Технический кремний получают в электропечах восстановлением SiO2 коксом или магнием: SiO2 + 2С = Si + 2СО SiO2 + 2Mg = Si + 2MgО
Таблица 7 Общие сведения
Атомные характеристики элементов Таблица 8
Таблица 9 Основные физико-химические свойства
Кремний высокой чистоты получают восстановлением SiCl4 водородом или цинком, а также термическим разложением его водородных соединений или SiI4:
SiH4 = Si + 2H2; SiI4 = Si + 2I2 Ge, Sn и Pb получают термическое восстановление их оксидов H2, C или CO: GeO2 + 2H2 = Ge + 2H2O SnO2 + 2C = Sn + 2CO PbO + CO = Pb + CO2 4.2. Химические свойства В соединениях углерод и кремний проявляют степени окисления −4, +2, +4; Ge, Sn, Pb − +2 и +4. Устойчивость соединений элементов в высших степенях окислениях от Si к Pb уменьшаются. По химическим и физическим свойствам углерод и его соединения резко отличаются от остальных элементов группы. Углерод способен образовывать кратные связи, цепи, кольца. При обычных условиях углерод и кремний весьма инертны, другие же элементы группы IVА достаточно активны и взаимодействуют со многими веществами. При увеличении температуры химическая активность всех веществ резко возрастает. На рисунке 10 представлена схема взаимодействия р – элементов IV группы с простыми веществами. Углерод переводится в раствор действием кислот – окислителей: С + 2H2SO4 (конц.) = CO2 + 2SO2 + 2H2O C + 4HNO3 (конц.) = CО2 + 4NO2 + 2H2O Кремний с обычными кислотами не реагирует. Взаимодействует с плавиковой кислотой, а также смесью HF и HNO3, легко растворяется в щелочах: Si + 4HF (г) = SiF4 + 2H2 (40-100 0C) Si (аморфн.) + 6HF (конц.) = H2 [SiF6] + 2H2 3Si + 18HF + 4HNO3 = 3H2 [SiF6] + 4NO + 8H2O 3Si + 18HF + 2KClO3 = 3H2 [SiF6] + 2KCl + 6 H2O Si + 2KOH + H2O = K2SiO3 + 2H2 Si (аморфн.) + 4NaOH (конц.) = Na4SiO4 + 2H2
Рис. 10. Схема взаимодействия элементов группы IVA с простыми веществами
Отношение Ge, Sn и Pb к кислотам и щелочам показано в таблице 10.
4.3. Бинарные соединения
Свойства бинарных соединений типа ЭХ4 (Х – галогены, водород) закономерно меняются от углерода к свинцу. Устойчивость таких соединений для углерода намного выше, чем для остальных элементов.
|






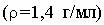 следует добавить к 50 г 10 % раствора хлорида алюминия для того, чтобы первоначально выпавший осадок полностью растворился?
следует добавить к 50 г 10 % раствора хлорида алюминия для того, чтобы первоначально выпавший осадок полностью растворился?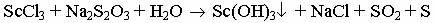

 составляет 1,252 В. Может ли сульфат таллия (III) окислить а) соляную кислоту; б) иодид калия?
составляет 1,252 В. Может ли сульфат таллия (III) окислить а) соляную кислоту; б) иодид калия?

 потребуется для растворения скандия, если в результате реакции образовалось 0,03 моль соли амммония?
потребуется для растворения скандия, если в результате реакции образовалось 0,03 моль соли амммония?