Строение мицелл лиофобных золей, коагуляция. Коллоидные раствора или золи – это микрогетерогенные системы, в которых дисперсная фаза в виде частиц (размером порядка 10-9 – 10-7 м) нерастворимого твердого
Коллоидные раствора или золи – это микрогетерогенные системы, в которых дисперсная фаза в виде частиц (размером порядка 10-9 – 10-7 м ) нерастворимого твердого вещества равномерно распределена в жидкой дисперсионной среде. Частицы дисперсной фазы золя вместе с окружающей их сольватной оболочкой из ионов и молекул дисперсионной среды называются мицеллами. Золи подразделяются на лиофильные и лиофобные (в случае водной дисперсионной среды – на гидрофильные и гидрофобные). В лиофильных золях частицы дисперсной фазы сильно взаимодействуют со средой (например, образуют водородные связи), или же межмолекулярное взаимодействие по обе стороны поверхности раздела «дисперсная фаза – дисперсионная среда» различается незначительно. Поэтому удельная свободная поверхностная энергия чрезвычайно мала, и межфазная граница может быть размыта. Такие золи образуются самопроизвольно и при сохранении условий их образования могут существовать сколь угодно долго. Примером лиофильных золей могут служить мицеллярные растворы поверхностно-активных веществ (ПАВ). В лиофобных коллоидах межмолекулярное взаимодействие в дисперсионной среде и дисперсной фазе существенно различно, удельная свободная поверхностная энергия велика, граница раздела фаз выражена достаточно четко. Избыток свободной поверхностной энергии обусловливает стремление частиц перейти в энергетически более выгодное состояние с меньшей поверхностью. Происходит укрупнение частиц. Чтобы лиофобные коллоиды были устойчивы, необходимо присутствие стабилизатора. Такие золи самопроизвольно не образуются, для их получения требуется затрата энергии. Лиофобные золи можно получить следующими способами: Диспергирование можно осуществить механическим раздроблением вещества в специальных коллоидных мельницах, в результате применения ультразвука, методом электрического распыления. Два последних метода диспергирования проводят в дисперсионной среде в присутствии стабилизатора. Конденсационные методы включают в себя: 1) физическую конденсацию (испарение вещества с последующей конденсацией в более крупные частицы); 2) химическую конденсацию (проведение реакции образования труднорастворимого вещества в разбавленном растворе, что обеспечивает малую скорость роста агрегатов, а, следовательно, и малые их размеры (10–9 – 10–7 м), в присутствии одного из компонентов реакции, выполняющего функцию стабилизатора коллоидных частиц); 3) метод замены растворителя (раствор вещества постепенно при перемешивании прибавляется к жидкости, в которой это вещество нерастворимо). При пептизации ионы пептизатора адсорбируются на поверхности слипшихся частиц, заряжая их одноименно. В результате частицы начинают отталкиваться друг от друга, постепенно распределяясь по всему объему дисперсионной среды. К лиофобным золям относятся почвенные коллоиды, природные воды, с коллоидно-химическими процессами связано производство вяжущих неорганических веществ, керамики, стекла. Сложные коллоидные системы содержат в своем составе животные и растительные организмы. Многие лекарственные вещества, средства борьбы с вредителями и сорняками применяются в коллоидном состоянии. Рассмотрим строение мицеллы лиофобного золя на примере образования коллоидного раствора иодида серебра при сливании разбавленных растворов нитрата серебра и иодида калия, причем KI взят в избытке и выполняет функцию стабилизатора. Иодид серебра образуется в результате обменной реакции: AgNO3+KI=AgI¯+KNO3. Микрокристалл малорастворимого иодида серебра, состоящие из m частиц AgI, называется агрегатом. На поверхности агрегата могут избирательно адсорбироваться ионы из раствора, причем в первую очередь адсорбируются те из них, которые присутствуют в избытке и родственны составу агрегата (правило Панета-Фаянса). В нашем примере – это анионы йода. Их называют потенциалопределяющими ионами. Допустим их n. Агрегат вместе с потенциалопределяющими ионами является частицей твердой фазы и называется ядром. За счет электростатического притяжения анионы йода будут удерживать возле себя катионы калия, которые также присутствуют в избытке. Эти катионы называются противоионами. Противоионы, наиболее близко расположенные к ядру, находятся в слое жидкости, смачивающей его поверхность, и испытывают не только электростатическое, но и ван-дер-ваальсово притяжение ядра. Поэтому эти ионы наиболее прочно связаны с ядром. Они называются противоионами адсорбционной сферы. Однако их количество недостаточно для полной нейтрализации суммарного заряда потенциалопределяющих ионов. Образование, состоящее из ядра и адсорбционной сферы противоионов, носит название коллоидной частицы или гранулы. Она несет заряд, равный алгебраической сумме зарядов ионов адсорбционной сферы. Остальные противоионы, слабее связанные с ядром, под действием теплового движения располагаются в жидкой фазе диффузно, то есть размыто. Они образуют диффузную сферу, нейтрализуя заряд коллоидной частицы. Гранула в совокупности с диффузной сферой образуют мицеллу. Мицелла электронейтральна. Схематично строение мицеллы рассматриваемого золя приведено на рисунке 2.8.1. При движении дисперсной фазы относительно дисперсионной среды граница скольжения проходит вблизи раздела между адсорбционным и диффузным слоем противоионов. То есть гранула движется как целое, а диффузный слой противоионов непрерывно переформировывается во время движения. { [AgI]m, n I–, (n-x) K+ } x – x K+
агрегат потенциал- противоионы противоионы определяющие адсорбционной диффузной ионы сферы сферы ядро коллоидная частица (гранула)
мицелла
Рисунок 2.8.1 – Схема строения мицеллы золя AgI при избытке KI Устойчивость гидрофобного золя не всегда обусловливается введением стабилизатора. Двойной электрический слой может образовываться и за счет ионогенных продуктов взаимодействия поверхности ядра с дисперсионной средой (например, золь гидратированного оксида кремния (IV)). Процесс слипания коллоидных частиц (потеря золем агрегативной устойчивости) называется коагуляцией. Процессу коагуляции золя способствуют вибрация, нагревание, замораживание, пропускание электрического тока, длительное стояние (старение золя), прибавление электролита. Коагуляцию вызывают ионы электролита, несущие заряд, противоположный по знаку заряду коллоидной частицы. В соответствии с правилом Шульце–Гарди, коагулирующее действие электролита сильно возрастает с ростом заряда иона-коагулятора. Минимальная концентрация электролита (может выражаться в моль/л, ммоль/л, кмоль/м3), вызывающая явную коагуляцию золя, называется порогом коагуляции. Порог коагуляции СК, выраженный в моль/л, может быть рассчитан по формуле:
где С(1/zX) – молярная концентрация эквивалента электролита Х, моль/л; VЭЛ.. и VЗ – объемы электролита и золя соответственно, л. Теоретические расчеты показывают, что порог коагуляции золя электролитом СК обратно пропорционален заряду иона-коагулянта Z в шестой степени: СК= K/Z6, где К — постоянная для данного золя величина. Если принять порог коагуляции трехзарядного иона за единицу, то для соотношения порогов коагуляции ионов с различными зарядами можно записать приближенно: СK(z=1):CK(z=2):CK(z=3)»730:11:1 В реальных системах могут наблюдаться отклонения от приведенных цифр, но порядки величин сохраняется. При сливании коллоидных растворов с противоположными зарядами частиц, может происходить взаимная коагуляция. Различают медленную и быструю коагуляцию. При медленной коагуляции не каждое столкновение между частицами приводит к их слипанию. Этот вид коагуляции на первых стадиях может не проявляться визуально. При быстрой коагуляции эффективным является каждое столкновение между частицами. Теорию кинетики быстрой коагуляции монодисперсных систем разработал Смолуховский. Он представил процесс уменьшения общего числа частиц во времени аналогичным реакции второго порядка, то есть скорость уменьшения числа частиц n за время t определяется уравнением:
где К – константа скорости коагуляции. После интегрирования этого уравнения получаем следующее выражение:
Если экспериментальные данные представить в виде графика зависимости Уравнение Смолухоского
где t - время коагуляции; nm – число частиц, являющихся агрегатом m -ного порядка по отношению к исходным частицам; n0 – первоначальное число частиц; К – константа скорости коагуляции.
где η; – вязкость среды. Для первичных частиц уравнение Смолуховского приобретает следующий вид:
Если ввести понятие времени половинной коагуляции t1/2 (время, необходимое для уменьшения числа первоначальных частиц вдвое,
При определенных условиях золи могут превращаться в гели – дисперсные системы с жидкой дисперсионной средой, в которой мицеллы образуют пространственную структурную сетку. Гели представляют собой тела, способные сохранять форму. Гели могут образовываться при коагуляции золей (если концентрация частиц достаточна для построения цельного каркаса), при понижении температуры, при концентрировании мицеллярных ПАВ. Образование и распад гелей происходит в ряде технологических, природных биохимических, почвенных и геологических процессах.
|

 , (2.8.1)
, (2.8.1) , (2.8.2)
, (2.8.2) или
или  . (2.8.3)
. (2.8.3) от t, то получится прямая линия. На основании графика можно определить значение К (как тангенс угла наклона прямой к оси абсцисс) и число исходных частиц n0 (отрезок, отсекаемый прямой на оси ординат, равен
от t, то получится прямая линия. На основании графика можно определить значение К (как тангенс угла наклона прямой к оси абсцисс) и число исходных частиц n0 (отрезок, отсекаемый прямой на оси ординат, равен  )
)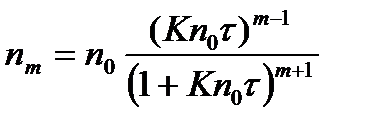 , (2.8.4)
, (2.8.4) , (2.8.5)
, (2.8.5)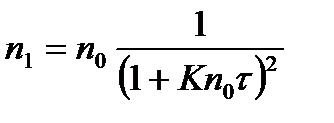 . (2.8.6)
. (2.8.6)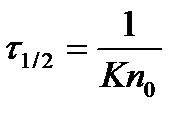 ), то предыдущее уравнение перепишется следующим образом:
), то предыдущее уравнение перепишется следующим образом: (2.8.7)
(2.8.7)


