Предлагаемое применениеОбычные буровые растворы Буровые растворы на пресной воде, обработанные каустической содой или разжижителями, содержащими каустическую соду, часто имеют нежелательно высокие СНС и вязкость, а также неустойчивую водоотдачу, неадекватную нормальными добавками гидрогеля. Имеющийся у нас опыт показывает, что такие состояния очень часто можно oбъяснить родом щелочности, имеющейся в буровом растворе. Вообще похоже на то, что различные формы щелочности можно соотносить с характеристиками бурового раствора следующим образом: Только ОН щелочность раствор стабилен и в хорошем состоянии. Щелочность ОН и СОз раствор стабилен и в хорошем состоянии. Только щелочность СОз раствор нестабилен и его трудно контролировать. Щелочность СОз и НСОз раствор не стабилен и его трудно контролировать. Только НСОз щелочность раствор не стабилен и его трудно контролировать. Исходя из вышесказанного, всегда желательно регулировать программу обработки таким образом, чтобы восстанавливать бикарбонатную щелочность до карбонатной, а карбонатную удалять или преобразовывать в гидроксидную. Изменить тип щелочности можно, поскольку бикарбонат не может существовать в присутствии гидроксида, так как восстанавливается до карбоната. Карбонат можно удалить добавлением кальция, образующего нерастворимый карбонат кальция. Для восстановления бикарбонатной щелочности до карбонатной обычно используют два распространенных материала: гашеную известь и каустическую соду. Выбор того или иного материала зависит от имеющегося в буровом растворе кальция и основывается на следующих реакциях, если в каждом случае имеются указанные исходные материалы. Если есть кальций: 1. Са(НСОз)2. + Ca(OH)2= 2СаСОз + 2Н2О 2. Са(НСОз) 2 + 2NaOH = СаСО3 + Nа2СОз + 2Н2О Если кальция нет: 3. NaHCO3 + Ca(OH) 2 = СаСОз + NaOH + Н2О 4. NаНСОз + NaOH = Na2CО3 + Н2O 5. Nа2СОз + Ca(OH) 2 = СаСОз + 2NaOH Обработку № 1 следует применять тогда, когда грамм-эквиваленты на литр имеющегося в буровом растворе кальция paвны или меньше грамм-эквивалентов на литр бикарбоната, или когда не ожидается дальнейшего загрязнения кальцием в иных формах, кроме бикарбоната кальция [Са(НСОз)2]. Эта обработка вызывает восстановление бикарбонатной щелочности до карбонатной, которая выпадает в осадок в виде карбоната кальция (СаСОз). Обработку № 2 следует применять в тех случаях, когда содержание кальция в буровом растворе в грамм-эквивалентах на литр выше, чем бикарбонатная щелочность в грамм-эквивалентах на литр. В результате образования кальцинированной соды (Nа2СОз) на каждый грамм-эквивалент на литр имеющегося бикарбоната можно удалить 2 грамм-эквивалента на литр кальция. Раствор, в котором содержится 20 грамм-эквивалентов на литр бикарбоната, будет свободен от кальция, если обработкой каустической содой восстановить бикарбонат до карбоната. Обработка № 3 используется в том случае, когда кальция в буровом растворе нет, и является средством преобразования бикарбоната натрия, который широко не применяется и обычно является загрязняющей примесью, в полезную форму каустической соды. Если система бурового раствора обрабатывается смесью каустической соды с квебрахо? и значительно увеличивается загрязнение его бикарбонатом натрия, то желательно уменьшить или даже прекратить добавление каустической соды и заменить ее известью Ca(OH)2 Обработка № 4 восстанавливает бикарбонат натрия до каустической соды и используется только в тех случаях, когда есть необходимосгь в предварительной обработке кальцинированной содой, в поддержании концентрации кальцинированной соды на уровне, необходимом при проходке гипса или ангидрита, в добавлении в воду затворения, в регенерации каустической соды из бикарбоната натрия или карбоната натрия, что объясняется ниже в описании обработки 5. Обработка № 5 также восстанавливает карбонат натрия до каустической соды и используется для поддержания гидроксидной щелочности, не увеличивая при этом количества образующейся карбонатной щелочности. Эту обработку можно проводить вместе с обработкой № 4, чтобы получить минимальную карбонатную щелочность и поддержать требуемую гидроксидную. 6.12. Методика определения содержания извести. 2. Добавьте 2-3 капли индикаторного раствора фенолфталеина. 3. При непрерывном помешивании начните добавлять из пипетки 0,02N (N/50) серной кислоты до тех пор, пока окраска бурового раствора не исчезнет. Число миллилитров 0,02 N кислоты называется Р щелочностью бурового раствора (Рm). 4. По вышеизложенной методике определите Pf. 5. Рассчитайте содержание извести следующим образом: 0,26 х (Pm - FwPf) = эквиваленту гидроксида кальция в фунтах/баррель Fw = объемный коэффициент воды в буровом растворе (по результатам определения содержания жидкой и твердой фаз) объемный процент воды Fw = ————————————
Если плотность раствора составляет 1,44 г/см3 или меньше, то приблизительное содержание извести в кг/м3 можно рассчитать по формуле: известь, кг/м3 = (Pm - Pf) x 0,714 6,13. Концентрация хлорида Методика 1. Влейте в чашку точно 1мл или кратно больше пробы фипьтрата раствора и добавкой дистиллированной воды доведите объем до 50 мл. 2. Добавьте несколько капель фенолфталеинового индикатора. При появлении розовой окраски, добавьте cepной кислоты до полного исчезновения окраски. 3. Добавьте 4-5 капель индикаторного раствора хромата калия для того, чтобы раствор стал ярко-желтым. При использовании 0,0282 N АgNO 3 нитрат серебра, мл Содержание Сl в мг/л = —————————— х 1000 проба, мл ^ При использовании 0,0280 N АgNO 3 нитрат серебра, мл Содержание Сl в мг/л = —————————— х 10000 проба, мл Сl, мг/л х 1,65 = NaCl, мг/л Сl, мг/л х 2,10 = KCl, мг/л Методика измерения 1. Влейте в чашку или мензурку точно 1 мл или кратно больше пробы фильтрата раствора и добавкой дистиллированной воды доведите объем приблизительно до 50 мл. 2. Добавьте 4 капли буферного раствора и 2 капли раствора Манвер. При наличии кальция или магния раствор станет красным. Вместо раствора Манвера можно добавить несколько крупинок индикатора Эрихром черный Т. 3. При непрерывном помешивании добавляйте титравер (1мл = 1г СаСОз) до изменения окраски с красной на синюю. Расчеты: титравер, мл х 1000 ———————— = жесткость в мг/л в пересчете на СаСО3 проба, мл (Са++ +Mg++) мг/л = 0,4 х жесткость в мг/л в пересчете на Са++ Методика измерения 1. Влейте в чашку или мензурку 1 мл пробы фильтрата и разбавьте небольшим количеством дистиллированной воды. 2. Добавьте две капли 8 N гидроксида калия 3. Добавьте несколько гранул индикатора Саlver II и взболтайте смесь так, чтобы она хорошо перемешалась. Вместо Calver II можно добавить несколько крупинок сухого индикатора Мурексида. 4. Титруйте титравером до изменения окраски с красной на синюю. Расчеты: титравер,мл х 1000 —————-—-------— =СаСОз мг/л проба, мл титравер, мл х 400 ------------------------- = Ca++мr/л проба, мл 6.16. Жесткость по магнию Жесткость по магнию - это разность между значением Са2- в мг/л, полученным по методу, при котором используется Манвер, и значением Ca2+, полученным при использовании индикатора Calve II. 6.17. Определение содержания солей в водной фазе РУО Метод предусматривает разрушение эмульсии горячей водой в присутствии деэмульгатора (дисольвана), разделение нефтяной и водной фаз и определение в отделённой твердой фазе содержания ионов хлора, магния, кальция и гидроксильных групп. В мерный 50мл цилиндр с притёртой пробкой вводят 20мл испытываемого раствора и добавляют 20мл дизельного топлива. Встряхивая, перемешивают содержимое в цилиндре, быстро отбирают 5мл смеси и переносят в делительную 75мл воронку, предварительно отградуированную на 50мл. Затем добавляют 10мл дисольвана и горячей дистилированной воды до метки. Всё это встряхивают, периодически осторожно приоткрывая пробку. После отстаивания (через 4-5 часов) в делительной воронке образуются три слоя: верхний - углеводородная фаза, средний - водная фаза с растворёнными в ней солями, нижний - утяжелитель. Водную фазу сливают в чистую сухую колбу и методами, указанными выше, определяют содержание ионов хлора, кальция, магния и гидроксильных групп. 6. 18. Концентрация сульфатов Методика определения 1. Влейте в цилиндр, мензурку или пробирку 2-4 мл фильтрата. 2. Добавьте несколько капель раствора хлорида бария. 3. Если в пробе есть сульфаты или карбонаты, они выпадут в осадок в виде молочно-белой массы. 4. Добавьте несколько капель концентрированной азотной кислоты. Если осадок растворяется - это карбонат, если нет - сульфат. 5. Результат запишите таким образом: следы, признаки, немного, много. 6.19. Катионнообменная емкость (МВТ) Оборудование Раствор метиленового синего (1 мл = 0,01 миллиэквивалента): содержащий 3,74 г метиленового синего х 4 (C16Н18N3,Cl х ЗН2О)* на литр 3% раствор перекиси водорода Разбавленная серная кислота, приблизительно 5? Шприцы Колба Эрленмейера на 125 мл Мерный цилиндр на 25 мл Палочки для перемешивания Электроплитка или нагреватель для бутылок Филыровальная бумага ватман № 4 * - патент США. ^ Методика определения Концентрации бентонита в буровых, растворах 1. Влейте в 125мл колбу 2,0 см3 бурового раствора. 2. Добавьте: а) 15см3 перекиси водорода (Н2О2) б) 1см3 серной кислоты (Н2SО4), если сернам кислота в капельнице, тогда добавьте 12 капель. Взболтайте смесь в течение 10 мин. 3. Прокипятите в течение 10 минут. 4. Дистиллированной водой доведите объем до?0 мл. 5. Начните добавлять по 1см3 раствор метиленового синего. 6. После каждого добавления встряхивайте колбу и удаляйте одну каплю пробы с конца палочки для перемешивания. 7. Наносите эту каплю на фильтровальную бумагу. Когда голубой краситель разойдется из этой точки и образует вокруг нее кольцо, титрование заканчивается. 8. После обнаружение образования такого кольца взбалтывайте колбу в течение еще двух минут, а затем перенесите еще одну каплю на фильтровальную бумагу. Если кольцо chова видно, значит конечная точка достигнута. Если кольцо не появилось, продолжайте делать то, что указано в этапах 5-7 до тех пор, пока вокруг капли, взятой после двух минут встряхивания, не появится голубое кольцо. Расчет: Бентонит (МВТ) кг/м3 = метиленовый синий, мл х 7,13 Примечания: 1. В буровых растворах часто кроме бентонита содержатся и другие вещества, которые адсорбируют метиленовый краситель Обработка перекисью водорода предназначена для ликвидации влияния таких органических материалов как КМЦ, полиакрилаты, лигнсульфонаты, лигниты. Так что мешать показаниям м огут только какие-то другие материалы. 2. Все нужные реагенты и оборудование поставляются npи заказе набора для исследования. 3. Растворы следует хранить в прохладном темном месте, что продляет срок их годности. Растворы метиленового синего и перекиси водорода следует обновлять каждые 4-6 недель. 6.20. Определение калия Седиментометрический экспресс-метод. Оборудование и материалы Центрифуга Градуированные пластмассовые центрифужные пробирки Стандартный раствор перхлората натрия (1?0 мг в 100 мл дистиллированной воды) Весы с гирями Бутылка проверочного раствора на калий Стандартная кривая для проверки на калий ^ Методика определения 1. Добавьте Змл раствора перхлората натрия к 7мл проверяемого раствора (фильтрата или отстоя после центрифугирования). 3. Если раствор нагреется, опустите пробирку нa 5 минут в холодную воду. 4. Центрифугируйте в течение 1 минуты при 500 – 1800 об/мин, а затем измерьте объем хлопьев. 5. Определите концентрацию ионов калия путем сравнения объема хлопьев со стандартной кривой для проверки на калий. Если стандартной кривой нет, её нужно построить по объемам хлопьев растворов с известной концентрацией КС1. Комментарии: 1. Этот тест специфичен для определения ионов калия. На него не влияют рН, полимеры, или другие ионы, например: Са++, Mg- +, Na+ и т.д. 2. Время центрифугирования должно оставаться неизменным независимо от типа используемой центрифуги. 6.21. Метод высокочастотного титрования ионов калия Данный метод основан на измерении высокочастотной электропроводности раствора, изменяющейся в процессе реакции: Na[B(C6H5)4] + КС1 → NaCI + К[В(С H5)4]↓
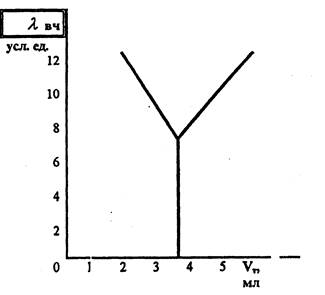
Рис. 6.1. Зависимость изменения высокочастотной электропроводности раствора λвч от объёма Vт тетрафенил бората натрия. Точку эквивалентности (рис6.1) фиксируют на пересечении двух прямых, отражающих изменение эквивалентной электропроводности (количест- ва и качества ионов) исследуемого раствора по мере прибавления титранта- тетрафенилбората натрия. Анализ исследуемого раствора можно проводить на любом высокочастотном титраторе. Ниже приводятся последовательность и методика анализа на осициллотитраторе системы «ПУНГОР» типа О?-302. Сначала определяют объем фильтрата, необходимый для проведения титрования. Для этого на предметное стекло нaносят несколько капель ис-следуемого фильтрата и прибавляют 2-3 капли те рафенилбората натрия. Если образуется светлая муть, то на титрование берут 0,5-1мл фильтрата. Если образуется белый хлопьевидный осадок (концентрация КС1>5%), то фильтрат разбавляют (5мл фильтрата помещают в мерную 100мл колбу и доливают дистиллированной водой до метки) и берут на анализ-5мл. В чистый химический стакан вместимостью 150мл отбирают аликвотную часть фильтрата. Стакан помещают в измерительную ячейку, сверху фиксируют его металлическим кольцом, снабженным резиновой прокладкой, и устанавливают металличсскую пластину - экран, охватывающую измерительную ячейку. В стакан доливают дистиллированной воды, чтобы мениск раствора был выше верхнего электрода, и устанавливают бюретку со стандартным раствором тетрафенилбората натрия. Стандартный раствор готовят путём растворения 17,1 г химически чистого Nа[B(C6H5)4] в 1л дистиллированной воды. Затем добавляют несколько капель разбавленного раствора хлорида алюминия (концентрации-0,1%), чтобы коагулировать нерастворимый осадок. После отстаивания раствор фильтруют. Хранить тетрафенилбората натрия рекомендуется в плотно закрытой: емкости из полиэтилена при температуре -5° С. Трёхпозиционный переключатель устанавливают в среднее положение, а переключатель чувствительности в положение, соответствующес оптимальной чувствительности прибора (её определяют предварительно). Прибор прогревают в течении 20-30 мин. Трёхпозиционный переключатель устанавливают в левое положение, включают магнитную мешалку и делают отсчёт по шкале индикаторного прибора. При непрерывном перемешивании добавляют по 1-2мл раствора титранта записывают показатели шкалы прибора и расход титранта. Строят кривую зависимости электропроводности раствора (в условных единицах шкалы) от расхода тетрафенилбората натрия (см.рис.1) и находят объём титранта V1, соответствующий эквивалентной точке. Концентрацию хлористого калия СKCl рассчитывают по формуле: СKCl=(N*V1* ЭKCl)/(V2*10) где: N - нормальность тетрафенилбората натрия, равная 0,5 н.; V1 - объём тетрафенилбората натрия, использованный на титрование, мл; Экс1 - эквивалент КС1, равный 74,5; V2 - объём исследуемого раствора, мл (если для определения берут разбавленный раствор, то объём титранта: V2 = 585/100 = 0,2 мл) Следует отметить, что содержание в растворе ионов Mg++, Са-+, Ва++, Na+, SО4-, Сl- до 2мг/мл не влияет на определение koличества хлористого калия. Относительная ошибка измерений не более 2%, продолжительность анализа 15-20мин. 6.22. Качественный метод контроля содержания водонепастворимых сульфидов в буровом растворе
склянки с притертыми пробками для хранения реактивов вместимостью 1000мл; делительная воронка; ацетат свинца (ГОСТ 1027-67), 10%-ный раствор; кислота соляная (ГОСТ 3118-77), 10%-ный раствор вода дистиллированная (ГОСТ 6709-72); индикаторная свинцовая бумага; магнитна мешалка. 2. Для определения содержания водонерастворимых сульфидов в буровых растворах на водной основе в колбу вместимостью 250 мл. наливают 25 мл. бурового раствора и 150 мл. дистиллированной воды, помещают магнит в полиэтиленовой оболочке и прибавляют 25 мл. 10%-ного раствора соляной кислоты. Затем колбу закрывают резиновой пробкой с трубочкой, заполненной селикагелем, пропитанным ацетоном свинца (или накрывают свинцовой бумагой), и ставят на магнитную мешалку. Потемневшее содержимое трубки (или свинцовой бумаги) будет свидетельствовать о наличии в буровом растворе водонерастворимых сульфидов. 3. Бypoвыe растворы на нефтяной основе разбавляют дизельным топливом в соотношении 1:1, 10 мл. полученной смеси в колбу вместимостью 100 мл., добавляют 10 мл. деэмульгатора (дисольвана) и тщательно встряхивают. Затем в колбу добавляют 10-20 мл. 10%-ного раствора соляной кислоты и быстро закрывают пробкой с трубкой, заполненной селикагегем, пропитанным ацетоном свинца (или накрывают свинцовой бумагой). Потемнение содержимого в трубке (или бумаги) будет свидетельствовать о наличии в буровом растворе водонерастворимых сульфидов. 4. Для ускорения анализа колбу нагревают до 50-60 °С и перевешивают с помощью магнитной мешалки. 6.23. Качественный метод контроля содержания сероводорода и водорастворимых сульфидов в буровом растворе 1. Для анализа необходимы реактивы и оборудование: колбы конические вместимостью 250мл (ГОСТ 1770-7 4Е); склянки с притёртыми пробками для хранения реактивов вместимостью 1000 мл; делительная воронка; ацетат свинца (ГОСТ 1027-67), 10%-ный раствор; едкий натр (ГОСТ 4328-77), 10%-ный раствор; вода дистиллированная (ГОСТ 6709-72); нитропруссид натрия, 10%-ный раствор.
Затем прибавляют по 10-15 капель 10%-ного раствора нитропруссида натрия (индикатора) и едкого натра. При наличии сероводорода и водорастворимых сульфидов раствор становится фиолетовым. 3. Буровой раствор на нефтяной основе разбавляют для анализа дизельным топливом в соотношении 1:1. Затем 10мл смеси помещают в делительную воронку, добавляют 25мл деэмульгатора (диссильвана) и горячую дистиллированную воду (до 100 мл общего объёма). Всё тщательно перемешивают, встряхивая, и оставляют в покое до расслоения, После этого водную вытяжку сливают в колбу и добавляют 10-15 капель 10%-ного раствора нитропруссида натрия (индикатора) и 5-10 капель 10%-ного раствора едкого натра. В качестве индикатора можно применять и 10 %-ный раствор ацетата свинца. При наличии в растворе водорастворимых сульфидов вытяжка становится фиолетовой. 1. Для.анализа количественного содержания в буровых растворах сероводорода и сульфидов используют реактивы и оборудование: делительную воронку; колбу круглодонную вместимостью 200 мл (ГОСТ 2!932-79); склянки Дрекселя с распылителем по капиллярной трубке вместимостью 200 мл; бюретки вместимостью 25 мл (ГОСТ 1770-74Е); колбу коническую для титрования (ГОСТ 1770-74Е); вакуумный насос; ацетат кадмия (ГОСТ 5824-79), 10%-ный раствор; кислота соляная (ГОСТ 3118-77), 10%-ный раствор; йод (ГОСТ 4159-79), 0,1 н. Раствор; натрий серноватисто-кислый (СТ СЭВ 223-75), 0,1н. раствор
…….. питанным ацетатом свинца. Затем трубку 7 соедин яют с вакуумным насосом и включают его. Через 1-2 мин открывают кран воронки и по каплям ……… puc. 6.3 …….. В результате реакции регенерации сероводорода силикагель темнеет, и высота eго окрашенного слоя будет прямо пропорциональна количеству сероводорода, выделившегося из раствора и постуившего в трубку 7 3. Для расчёта концентрации сероводорода и сульфидов в исследуемой пробе используют формулу CН2S = H x l000 / KV Где CН2S - концентрация сероводорода в пробе, мг/л; Н- высота окрашенного слоя силикагеля, мм; К- коэффициент трубки; V- объём пробы бурового раствора, мм3? 4. Установку можно использовать как в лабораторных, так и в промысловых условиях для количественного определения сероводорода и сульфидов в буровых растворах на водной и нефтяной основе. 6.25. Методика определения содержания карбонатного утяжелителя в буровом растворе Оборудование: 1. Сушильный шкаф, электрическая плитка. 2. Цилиндр на 50 -100 мл. 3. Фарфоровая чашка, на 100 - 200 мл. 4. Весы с разновесами. 5. Соляная кислота 15% - ной концентрации 6. Стеклянная воронка. 7. Фильтровальная бумага. 8. Стеклянный стакан на 100 - 200 м. Процедура После последних 2-3 замеров фильтрации оставляют 2-3 фильтра с коркой. Затем переносят их в фарфоровую чашку и помещают в разогретый сушильный шкаф. Сушат при температуре 110-120°С (можно 150°С) до постоянного веса. При отсутствии сушильного шкафа, сушку необходимо осуществлять осторожно на электрической плитке. Высушенную твердую фазу ссыпают в фарфоровую чашку и измельчают до порошка из чашки. Берут навеску (P1) в 5г и переносят в чистую фарфоровую чашку или в стеклянный стакан. В сосуд с порошком добавляют 15%-ную соляную кислоту, примерно 40-50мл на 5г твердой фазы. Смесь перемешивают 15-20 мин до прекращения реакции (прекращается выход, газа из реакционной смеси). Предварительно взвешенную и высушенную фильтровальную бумагу (Р2) помещают в стеклянную воронку и выливают на нее суспензию в кислоте. После отфильтровывания, стакан(чашку) npoмывают дистиллированной водой и переносят остаток вновь на фильтр. После завершения фильтрации фильтр вместе с осадком помещают в сушильный шкаф (или на плитку) и сушат до постоянного веса (Рз). Расчет содержания карбонатного утяжелителя в твердой фазе бурового раствора производят по следующей формуле ССаСОз,% = (P1 + P2 – Р3) / P1 х 100 (6, I) Содержание шлама определяется как: Сш,% = 100% - ССаСОз ,% Содержание карбонатного утяжелителя в 1м3 определяется по формуле: 2,6(рр-1) МСаСОз, кг/м3 = 10 х --———----——: ССаСОз 2,6 - 1 где: рр - плотность раствора, г/см3; 2,6 - усредненная плотность выбуренной породы и карбонатного утяжелителя, г/см3; 1 - плотность воды, г/см3. Заключение Данное учебное пособие предназначено для специалистов. в области бурения и химиков при обучении специальности «Технология приготовления и применения буровых растворов». Курс обучения рассчитан на 30-40 дней. Обучение планируется проводить в центральной лаборатории «ИКФ» или в регионах, где имеются соответствующим образом оснащенные лаборатории. После обучения необходима стажировка ученика в течение нескольких месяцев под руководством опытного специалиста «ИКФ». С первого дня обучения ученик обеспечивается на постоянное пользование данным учебным пособием. Поэтому как во время обучения, стажировки, так и последующей самостоятельной работы специалист имеет возможность постоянно совершенствовать и закреплять свои знания. «ИКФ» на ochoвании имеющейся лицензии на обучение № Ю-К-01/9062 от 26.10.98 выдает сертификат специалиста по буровым растворам. Основываясь на международный опыт, «ИКФ» планирует также обязательную переподготовку специалистов. Данное пособие является первым изданием и поэтому в последующем будет дополняться и совершенствоваться. ***********************************************************************
|