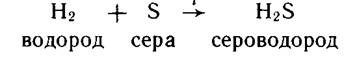Лабораторное Получение водорода
Один из способов получения водорода вам уже знаком. Это разложение, воды при действии постоянного электрического тока:
В лабораторных условиях водород проще получить при взаимодействии некоторых металлов с кислотами. Обычно используют цинк и растворы соляной НС1 или серной H2S04 кислоты. Для собирания водорода над водой, который выделяется в этих реакциях, можно использовать прибор, изображенный на рисунке 1. Для получения водорода пользуются также аппаратом Киппа (рис. 2). Так как водород легче воздуха, его собирают в приборе, как показано на рисунке 43. Реакции можно выразить при помощи следующих уравнений:
Рис.1 Собирание водорода методом вытеснения воды.
Рис. 2. Аппарат Киппа: 1 — кислота.
Водород выделяется также при взаимодействии активных металлов (например, Na, Са) с водой (рис. 4). Эти реакции протекают бурно, иногда со взрывом. Поэтому для опыта следует брать небольшой кусочек металла, а пробирку накрыть воронкой.
Рис. 3. Взаимодействие натрия с водой
Рис. 4. Собирание водорода методом вытеснения воздуха
Опытным путем установлено, что из молекулы воды вытесняется только один атом водорода и образуется одновалентная группа ОН — гидроксогруппа, которая соединяется с атомом металла. Число гидроксогрупп зависит от валентности металла. Образующиеся соединения относятся к основаниям, а конкретные представители этого класса веществ называются гидроксидами. Химические реакции, протекающие между активными металлами и водой, можно выразить следующими уравнениями:
1.3 Физические свойства
Водород — бесцветный, самый легкий газ. Он в 14,5 раза легче воздуха (1 л весит 0,09 г). Поэтому если мыльные пузыри наполнить водородом, то они поднимаются вверх (рис. 45). Растворимость водорода в воде очень мала, а температура сжижения чрезвычайно низкая (—252,8 °С).
1.4 Химические свойства
1.4.1Водород соединяется с кислородом Если зажечь водород (после проверки на чистоту, см. далее) и трубку с горящим водородом опустить в сосуд с кислородом, то на стенках сосуда образуются капельки воды:
Водород без примеси сгорает спокойно. Однако смесь водорода с кислородом или воздухом взрывается. Наиболее взрывчата смесь, состоящая из двух объемов водорода и одного объема кислорода,— гремучий газ. Если взрыв произойдет в стеклянном сосуде, то его осколки могут поранить окружающих. Поэтому, прежде чем поджигать водород, необходимо проверить его на чистоту. Для этого собирают водород в пробирку, которую в положении вверх дном подносят к пламени. Если водород чистый, то он сгорает спокойно, с характерным звуком «п-пах». Если же водород содержит примесь воздуха, то он сгорает со взрывом. При работе с водородом следует соблюдать правила техники безопасности.
1.4.2Взаимодействие водорода с оксидами некоторых металлов Если, например, при нагревании пропускать над оксидом меди (II) струю водорода (рис. 5), то происходит реакция, в результате которой образуются вода и металлическая медь:
Рис. 5
В этой реакции происходит процесс восстановления, так как водород отнимает кислород от атомов меди. Процесс восстановления противоположен процессу окисления. Вещества, которые отнимают кислород, относятся к восстановителям. Процессы окисления и восстановления взаимно связаны (если один элемент окисляется; то другой восстанавливается, и наоборот). В уравнении реакции это можно показать так:
Рис. 6. Горение водорода в атмосфере хлора.
При взаимодействии водорода с азотом (при повышенных температуре и давлении в присутствии катализатора) образуется аммиак NH3, имеющий большое практическое значение. Водород реагирует также с активными металлами с образованием нелетучих соединений — гидридов
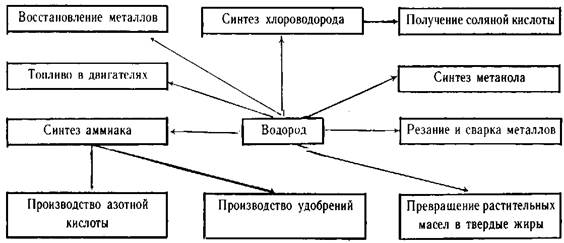
1.5 Применение
Водород используется как восстановитель ценных металлов и для синтеза многих веществ. Применение водорода основано также на его способности гореть с выделением большого количества теплоты. Особенно большое значение в перспективе будет иметь водород как экологически чистое топливо, ибо при его сгорании образуются водяные пары, не отравляющие атмосферу. Для осуществления этой идеи потребуется разработать экономически выгодные условия проведения реакции разложения воды:
|