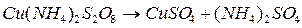КЕЛІСІМ ПАРАҒЫ
САЛЬВАТОРЕ: (Входит в прихожую в сопровождении двух других работников) Багаж уложен. Может, еще раз выпьем на дорогу? ТУЛЛИО: Непременно! (Наливает вино в три бокала). Вам - счастливо оставаться здесь, а нам – хорошего отпуска!
Азаќстан республикасыныњ білім жєне ѓылым министрлігі Ж±банов атындаѓы Аќтµбе мемлекеттік университеті Ф 06.01-01 « Бекітемін» Ќ Ж±банов атындаѓы Аќтµбе мемлекеттік университетініњ ректоры профессор ____________К.К. Кенжебаев «_____»____________200__ж.
К‰ндізгі оќу бµлімініњ II курс студенттеріне арналѓан «Физикалық және коллоидтік химия» пєні бойынша ЛАБОРАТОРИЯЛЫЌ Ж¦МЫСТАРЃА АРНАЛЃАН ЄДІСТЕМЕЛІК Н¦СЌАУЛАР
Аќтµбе – 2006 ж. I. ЛАБОРАТОРИЯЛЫЌ Ж¦МЫСТАРЃА АРНАЛЃАН ЄДІСТЕМЕЛІК Н¦СЌАУЛАРДЫ ҚҰРАСТЫРҒАН ЖӘНЕ ЕНГІЗГЕН Орындағандар _____оќытушы______ ________ Байсанова Ш.З. (қызметі, бөлімі) (қолы) (аты-жөні)
«___»____________ 200 ж.
Жауапты орындаушы– кафедра меңгерушісі ________________________ _________ К.К. Каскин (қызметі, бөлімі) (қолы) (аты-жөні) «___»____________200__ ж.
II. КАФЕДРА ОТЫРЫСЫНДА ТАЛҚЫЛАНДЫ Хаттама № «» _____________ 200 __ ж. III. РЕЦЕНЗЕНТІ _________________________ ________ _______________________ (қызметі, бөлімі) (қолы) (аты-жөні)
«___»____________200__ ж. IV. ФАКУЛЬТЕТТІҢ ОӘК БЕКІТІЛУГЕ ҰСЫНЫЛДЫ Ж. V. АЛҒАШҚЫ ТЕКСЕРУ МЕРЗІМІ 200__ ж. АЙТАЛАП ТЕКСЕРУ МЕРЗІМІ 1 жыл
VI ОРНЫНА АУЫСТЫРЫЛЫП ЕНГІЗІЛДІ______________________ алдыңғы єдістемелік н±сќаудың бекітілген күні КЕЛІСІМ ПАРАҒЫ
ЛАБОРАТОРИЯЛЫЌ Ж¦МЫСТАЃА АРНАЛЃАН ЄДІСТЕМЕЛІК Н¦СЌАУ
Мамандығы: 050709 Металлургия Пән Физикалық және коллоидтік химия Білім деңгейі Жоғары кєсіптік білім (бакалавр) Оқыту түрі Күндізгі Оқу жылы 2005-2006 ж.
Оқу ісі жөніндегі проректор Айпеисова С.А.
«___»____________200__ ж.
Келісім:
Оқу – ұйымдастыру қызметінің бастығы:
№___ Сабаќ Таќырыбы: «АЦЕТОНДЫ ЙОДТАУ РЕАКЦИЯСЫНЫҢ ЖЫЛДАМДЫҚ КОНСТАНТАСЫН ЖӘНЕ АКТИВТЕНДІРУ ЭНЕРГИЯСЫН АНЫҚТАУ»
Ж±мыстыњ маќсаты: 1. Химиялық процестердің жылдамдығына температураның әсерін зерттеу 2. Зерттелетін реакцияның активтендіру энергиясының графикалық және есептік т‰рде анықталуы.
Материалдар жєне жабдыќтар: термостат, бюретка, пипеткалар, 250 мл колбалар, 4% KJ; 0,1н J2, 1н HCl, 0,01 н Na2S2O3, 0,1 н NaHCO3, ацетон, крахмал Ж±мыстыњ мазм±ны жєне орындалу тєртібі:
ТЕОРИЯЛЫҚ БӨЛІМ. Бір фазада өтетін химиялық реакцияны гомогенді химиялық реакция деп атаймыз. Гомогенді реакцияға ерітіндіде өтетін реакциялар мысал бола алады. Химиялық әрекеттесудің интенсивті сипаттамасы болып химиялық реакцияның жылдамдығы саналады. Химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрациясының уақыт бірлігіндегі өзгерісімен анықталады - орташа жылдамдық, уақыт моментінде - шынайы жылдамдық.
Жылдамдық әрекеттесуші заттардың табиғатына, олардың концентрациясына және µзгі заттардың (мысалы, катализаторлардыњ) болуына, олардыњ концентрациясына, реакция µтетін ортаѓа жєне жаѓдайына, температураѓа, ќысымѓа (єсіресе газдар ќатысумен µтетін реакицялар ‰шін),сєулененуге (фотохимиялыќ реакциялар) жєне т.б. тєуелді болады. Әрекеттесуші массалар заңына сәйкес (ӘМЗ-I)
реакциясы үшін тіке процестің жылдамдығы:
ал,кері процестің жылдамдығы
мұнда, Реакцияның жылдамдық константасы дегеніміз - реагенттердің бірлік концентрациясы кезіндегі реакцияның жылдамдығын анықтайтын т±раќты шама. Осы жылдамдық константасының сандық мәні концентрация және уақыт бірлігінің таңдалуына байланысты. Әдетте концентрацияны мольдің литрге қатынасымен, ал уақытты минутпен немесе секундпен көрсетеді. Реакцияның реті мен молекулалыѓын айырады: Әрекеттесудің қарапайым актісінде қатысатын реагенттердің молекула санын реакцияның молекулалыѓы деп атаймыз. Моно-, би-, тримолекулалыќ реакциялар белгілі. Реакцияның реті деп - реакцияның кинетикалық теңдеуіндегі концентрациясы жанындаѓы дәреже көрсеткішін айтады. Реакциялар нөлінші, бірінші, екінші және үшінші жєне бөлшекті ретті болып келеді:
Реакцияның реті мен оның молекулалыѓы көбінесе сєйкес келмейді. Бірінші ретті реакциясын схема түрінде келесі теңдеумен көрсетуге болады:
Мұндай реакцияның жылдамдығы мынаған тең:
мұнда немесе интегралдағаннан кейін:
Реакция ағысының уақыты:
мұнда,
Екінші ретті реакцияны схема түрінде келесі теңдеумен көрсетуге болады:
Оның жылдамдығы мынаған тең:
немесе интегралдағаннан кейін:
Реакция ағысының уақыты:
Егер реакция µнімініњ біреуі катализатор болса, онда бұл реакция автокаталитикалық деп аталады. Мұндай реакцияныњ мысалы ретінді ацетонның йодталу реакциясы бола алады. Химиялық реакцияның жылдамдығына процестің температурасы әсер етеді. Төмен температуралар облысындағы реакция жылдамдығының температураға тәуелділігін Вант-Гоффтың эмпирикалық ережесімен анықталады: Температураны әрбір он градусқа жоғарылатқанда реакцияның жылдамдығы екі - төрт есе артады:
Температураның еркін өзгерісі кезінде Вант-Гоффтың ережесі келесі түрге ие болады:
мұндағы, γ - реакцияның температуралық коэффициенті.
«Жоғары» және «төмен» температуралар облыстары реагенттердің табиғатымен анықталатын салыстырмалы ұғым. Жоғары температуралар облысында реакция жылдамдығының температураға тәуелділігі Аррениустыњ ережесімен анықталады: Реакцияныњ жылдамдық константасының логарифмі кері температураға сызықты тәуелді.лікті білдіреді.
м±нда А жєне В – т±раќтылар.
0 Негізінен Аррениус теңдігі Ван-Гоффтың изобарасының анықталмаған интегралы болып табылады:
ал экспоненциалды формада
мұнда,
Сонымен, активтендіру энергиясы Вант – Гофф изобарасының интегралдық теңдеулері бойынша аналитикалық және графикалық есептелуі мүмкін.
Реакцияның өту себебі болып молекулалардың соқтығысуы саналады, бірақ Аррениус көрсетіп кеткендей молекулалардыњ барлық соқтығысулары химиялық өзара әрекеттесуге әкелмейді. Реакцияға жалпы соқтығысулар санының аз мөлшерін ғана құрайтын бөлшектердің эффективті соқтығысулары әкелуге тиіс. Аррениус теңдігінің молекулярлы-кинетикалық түсінігін Алексеев ұсынды. Ол жоғары энергия қорына ие болатын молекулаларды активті деп санауды ±сынѓан. Реакцияның активтендіру энергиясы деп химиялық әрекеттесу актісі µту ‰шін қажетті және жеткілікті энергияның минимальді қоры.
Реакция жылдамдығының (20) тењдеу бойынша есптелуі көбіне жоғары нәтиже береді, әсіресе ерітіндідегі реакциялар үшін. Есептелген мєліметтерді тәжірибелік мєліметтермен салыстыру ‰шін тењдеулерге стериялық немесе ықтималдыќ факторы деп аталатын қосымша Р көбейтіндісі енгізіледі.
Cтериялық фактор Р реагенттердің табиғатына байланысты және 1-ден Активті соқтығысулар теориясына (АСТ) сәйкес стериялық фактор реакция өтуі үшін ќажетті бөлшектері соқтығысуы кезінде керекті кеңістік баѓытты болады, осыдан бұл көбейтіндінің аты пайда болған. Бірақта АСТ теориясы экспонента алдындағы көбейткішті және стериялық факторды есептеуге мүмкіндік бермейді. Активті комплекстер теориясына (АКТ) сєйкес стериялық фактор мына теңдеумен есептелуі мүмкін: Р мұнда, ∆S* - активтендіру энтропиясы, яғни, бір моль активті комплекс түзілгендегі энтропияның өзгерісі. «Стериялық фактор» деген атау физикалық мағынаны білдірмейді. Сондықтан да бұл көбейткішті энтропиялық немесе ықтималдық фактор деп атаған жөн. Аралыќ активті комплекстыњ теориясы активтендіру энергиясы ±ѓымыныњ ќатањыраќ аныќтауѓа мүмкіндік береді. Температураның процестің жылдамдығына әсерін берілген жұмыстағы ацетонды йодтау реакциясын зерттегендегі мысалда қарастырамыз. Ацетонды йодтау реакциясы мына теңдік бойынша жүреді:
Процесс автокаталитикалық өтеді, яғни реакцияға қатысқан заттың біреуімен жылдамдатылады (сутегі иондарымен). Сутегі иондары болмаса, процесс өте баяу жүреді. Ацетонды йодтау 2 сатымен жүреді: 1. Ацетонды енолизациялаудың қайтымды реакциясы
О ОН 2. Йодтың енольді формамен өзара әрекеттесуі
ОН О Бірінші реакция баяу, ал екіншісі тез және аяғына дейін жүреді. Сондықтан да процестің жылдамдығы ацетонды енолизациялау жылдамдығымен анықталады. Ол сутегі иондарының концентрациясына пропорционалды, бірақ йодтың концентрациясына тәуелді емес, яғни келесі (25) -ші теңдікке сәйкес:
жєне
мұнда
ТӘЖІРИБЕЛІК БӨЛІМ.
Тәжірибені екі температурада жүргізеді: 1. 250 мл µлшеу колбаларына 4% КI ерітіндісіндегі 0,1Н иод ерітіндісін 25 мл-ден құю керек. 2. 1Н тұз қышқылының 25 мл-ден қосу керек. 3. Шамамен 35- 40 мл-ден төмен көлемге дейін су қосу керек. 4. Жұмысшы ерітіндісі бар екінші колбаны және дистилденген суы бар басқа қосымша колбаны термостатқа 15-20 минутқа салып қою керек. 5. Титрлеу үшін бюретка дайындау керек, яғни 0,01Н гипосульфит 6. Титрлеу үшін 3 колбадан дайындау керек (тәжірибенің екі температурасы үшін), яғни колбаларға 0,1Н натрий гидрокарбонатын 7. Жұмысшы ерітіндісі бар колбаларға 1,88 мл ацетон (яғни 1,5 г ацетон ќ±райтын) қосу керек Ацетонды құйған кезді сағатпен белгілеу қажет. Осы уақытты реакцияның басы деп қабылдау керек! 8. Жұмысшы колбадағы ерітіндініњ көлемін тез термостатта ұсталған дистилденген сумен белгілі деңгейге дейін жеткізу керек (бөлме температурасынан жоғары температурадағы тәжірибе үшін) жєне жақсылап араластыру керек! 9. Титрлеу үшін дайындалѓан колбаларға 25 мл-ден екі сынаманы пипеткамен алу керек.Осы кезді уақытпен белгілеу ќажет! Ацетонның ұшып кетпеуі үшін реакциялық қоспасы бар колбаны тығынмен жабады! 10. Иодтың мµлшерін крахмалдың қатысуымен 0,01Н 11. Сынамаларды алуды және титрлеуді 20 минут сайын тағыда 3 рет қайталау қажет!
Назар аударыңдар! Сынама алу кезінде колбаны термостаттан шығармау керек! - Бөлме температурасында тәжірибе жүргізген кезде сынаманы әр 20 минут сайын алу керек. - - Тәжірибе барысында 4 сынамаѓа дейін алу керек.
Өлшеулер мен бақылаулардың қорытындысын 1,2 кестелерге келтірген.
Кесте 1
Кесте 2
мұнда
- Миллиметровкаға Ацетонның бастапқы концентрациясын - 1000 мл –де ацетонның мµлшері - бұл ацетонның мµлшерін моль арқылы өрнектейді (Мац=58г/моль)
Кµлемі 250 мл реакциялыќ ќоспаѓа 1 Н 25 мл т±з ќышќылы енгізетін сутегі иондарыныњ - Кµлемі 250 мл реакциялық қоспаға енгізілген 25 мл 1Н тұз қышқылының мµлшерін анықтау ќажет - 1000 мл-дегі сутегі иондарыныњ мµлшерін анықтау ќажет - алынған ерітіндінің нормальдігін анықтау керк (егер 1Н тұз қышқылыныњ 1000 мл ерітіндісінде 36,5 г НCl болса). (25)-ші есептеу теңдігін және
ҚОРЫТЫНДЫ.
Қорытындыда зерттелген реакцияның кинетикалық ерекшеліктерін, жылдамдықтың температураға тәуелділігінің ерекшеліктерін және активтендіру энергиясының мәндерін белгілейді.
Ж±мысты орындаѓан: Ж±мысты ќабылдаѓан: ___________________ ___________________ студенттіњ ќолы оќытушыныњ ќолы, мерзімі
Ж¦МЫСЌА ЖІБЕРІЛУ СҰРАҚТАРЫ.
1. Жұмыстың мақсаты қандай? 2. Зерттелетін реакцияның жылдамдығына температураның жоғарылауы қалай әсер етеді? 3. Процесс барысында иодталу жылдамдығы тәжірибе жүзінде қалай аныќталады? 4. Иодталудың кинетикалық теңдігін жазыңдар. 5. Иодталудың химиялық теңдігін жазыңдар. 6. Қай реактив реакцияға сутегі иондарын енгізеді? Оның тәжірибе алдындағы бастапқы көлемі мен концентрациясы және соңғы көлемі мен концентрациясы қандай? 7. Ацетонның бастапқы концентрациясы 8. Титрлеу үшін қандай реактив қолданылады және реакцияның бастапқы кезінде оның шығыны қалай анықталады? 9. Қай теңдік дұрыс және иодталу реакциясының жылдамдық константасын көрсетеді? 10. Зерттелетін реакцияның температуралыќ коэффициентін және активтендіру энергиясын қай тәуелділік бойынша анықтайсыңдар?
БАҚЫЛАУ СҰРАҚТАРЫ. ВАРИАНТ 1 1. Физикалыќ маѓыналарды атањдар: 1.1. активация 1.2. энтальпия 1.3. реакция жылдамдыѓыныњ константасы 1.4. экспонента алдындаѓы кµбейткіш 1.5.эффективті соќтыѓысу 2. Вант –Гофф ережесініњ анализін беріњдер 3. АКТ теориясы бойынша реакция жылдамдыѓын т‰сіндіріњдер 4. Активтендіру энергиясын графикалыќ ќалай аныќтауѓа болады? 5. Не ‰шін титрлеу кезінде натрий бикарбонатыныњ ерітіндісі ќолданылады? 6. Реакцияныњ температуралыќ коэффициенті деген не? 7. Келесі реакцияныњ активтендіру энергиясын аныќтањдар:
егер 270С температурада реакцияныњ жылдамдыќ константасы 1,0.10-2 л/моль.мин тењ болса, ал 670С – 4,00.10-2.
ВАРИАНТ 2 1. Физикалыќ маѓыналарды атањдар: 1.1. активтендіру энергиясы 1.2. тепе – тењдік константасы 1.3. изобарлыќ потенциал 1.4. стериялыќ фактор 1.5. лимиттеуші саты 2. Аррениус ережесініњ анализін беріњдер 3. АСТ теориясы бойынша реакция жылдамдыѓын т‰сіндіріњдер 4. Активтендіру энергиясын аналитикалыќ т‰рде ќалай аныќтауѓа болады? 5. Не себептен ацетонды иодтау реакциясыныњ жылдамдыѓы иодтыњ концентрациясына тєуелсіз? 6. Температуралыќ коэффициент ќалай аныќталады? 7. Кейбір заттыњ ыдырауы активтендіру энергиясы 250 кДж/моль тењ бірінші ретті реакциясы болып саналады. 3000К температурада осы заттыњ ыдырауы саѓатына 90% жылдамдыѓымен µтеді. Осы зат минутына 0,1 % жылдамдыѓымен ыдырайтын температураны аныќтањдар.
БЛИЦ – ТЕСТ
|


 (1)
(1) (2)
(2)
 (3)
(3) (4)
(4) жєне
жєне  – реакцияныњ жылдамдыќ константалары.
– реакцияныњ жылдамдыќ константалары.
 (5)
(5)
 (6)
(6)
 (7)
(7) (8)
(8) - τ = 0 тењ болѓан кезіндегі А затының бастапқы концентрациясы.
- τ = 0 тењ болѓан кезіндегі А затының бастапқы концентрациясы. - берілген уаќыт моментіндегі заттыњ концентрациясы.
- берілген уаќыт моментіндегі заттыњ концентрациясы.
 (9)
(9) (10)
(10) (11)
(11)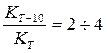 (12)
(12) (13)
(13) (14)
(14) (15)
(15)


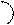
 (16)
(16)


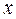



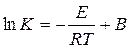 (17)
(17)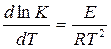 (18)
(18) (19)
(19)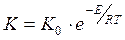 (20)
(20) - экспоненциал алдындағы кµбейткіш деп аталатын эмпирикалыќ тұрақты:
- экспоненциал алдындағы кµбейткіш деп аталатын эмпирикалыќ тұрақты: (21)
(21) (22)
(22) графигінен
графигінен Энергиясы Е-ге тең немесе үлкен бөлшектерді активті деп атайды. Бұл энергия энергетикалық бөгеттерден өту үшін қажет, яғни ќазіргі т‰сініктер бойынша соқтығысатын молекулалардың электрондық бұлттар тебісуініњ энергиясын жењу үшін.
Энергиясы Е-ге тең немесе үлкен бөлшектерді активті деп атайды. Бұл энергия энергетикалық бөгеттерден өту үшін қажет, яғни ќазіргі т‰сініктер бойынша соқтығысатын молекулалардың электрондық бұлттар тебісуініњ энергиясын жењу үшін. Р
Р  (23)
(23) -не дейін өзгеруі мүмкін. Кейбір ерітінділерде µтетін иондық реакциялар үшін стериялық фактор 1-ден үлкен болуы мүмкін.
-не дейін өзгеруі мүмкін. Кейбір ерітінділерде µтетін иондық реакциялар үшін стериялық фактор 1-ден үлкен болуы мүмкін. (24)
(24)


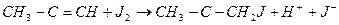
 (25)
(25)
 (26)
(26) ацетонның бастапқы концентрациясы.
ацетонның бастапқы концентрациясы. сутегі иондарыныњ бастапқы концентрациясы.
сутегі иондарыныњ бастапқы концентрациясы.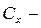
 уақыт ішінде түрленетін ацетонның концентрациясы (концентрацияның азаюы).
уақыт ішінде түрленетін ацетонның концентрациясы (концентрацияның азаюы). реакцияның басынан берілген өлшеуге дейінгі уақыт.
реакцияның басынан берілген өлшеуге дейінгі уақыт. -бөлмелік жєне
-бөлмелік жєне  -ұстаздың айтуымен. Бөлме температурасынан жоғары температурада тәжірибені термостатта жүргізу керек.
-ұстаздың айтуымен. Бөлме температурасынан жоғары температурада тәжірибені термостатта жүргізу керек. ерітіндісімен толтыру керек.
ерітіндісімен толтыру керек. 25 мл-ден құю керек.
25 мл-ден құю керек. және одан жоғары температурада 10 минут сайын алу керек.
және одан жоғары температурада 10 минут сайын алу керек. ТӘЖІРИБЕЛІК МЄЛІМЕТТЕРДІ ¤ЊДЕУ.
ТӘЖІРИБЕЛІК МЄЛІМЕТТЕРДІ ¤ЊДЕУ.


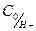



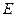
 шамасы келесі теңдік бойынша анықталады:
шамасы келесі теңдік бойынша анықталады: (24)
(24) уақыт ішінде сәйкес пробаны титрлеуге жұмсалған
уақыт ішінде сәйкес пробаны титрлеуге жұмсалған 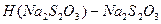 ерітіндісінің нормальдігі.
ерітіндісінің нормальдігі. реакцияның басталуы моментінде титрлеуге ж±мсалуы мүмкін
реакцияның басталуы моментінде титрлеуге ж±мсалуы мүмкін  мәнін тєжірибе ж‰зіндеаныќтай алмаймыз, себебі, ацетонды құю уақытынан бірінші сынаманы алу уақытына дейін айтарлықтай уақыт өтеді. Сондықтан
мәнін тєжірибе ж‰зіндеаныќтай алмаймыз, себебі, ацетонды құю уақытынан бірінші сынаманы алу уақытына дейін айтарлықтай уақыт өтеді. Сондықтан  координаттарында график тұрғызылады жєне алынған сызықты ордината осіне дейін экстраполяциялау арќылы
координаттарында график тұрғызылады жєне алынған сызықты ордината осіне дейін экстраполяциялау арќылы  кезінде
кезінде  есептеу үшін 1,5 г ацетонның реакциялық қоспаныњ 250 мл көлемінде бар екенін ұмытпау керек, яғни, қайта есептеу жүргізіледі:
есептеу үшін 1,5 г ацетонның реакциялық қоспаныњ 250 мл көлемінде бар екенін ұмытпау керек, яғни, қайта есептеу жүргізіледі: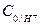 бастапқы концентрациясын есептеуді келесі тєртіппен ж‰ргізу керек:
бастапқы концентрациясын есептеуді келесі тєртіппен ж‰ргізу керек: мәндерін қолдана отыра, К жылдамдық константасын есептейді жєне мєндерін кестеге келтіреді. Содан соң К шамасының орташа мәнін анықтап,
мәндерін қолдана отыра, К жылдамдық константасын есептейді жєне мєндерін кестеге келтіреді. Содан соң К шамасының орташа мәнін анықтап,  температуралық коэффициентін, аналитикалық және графикалық түрде активтендіру энергиясын есептеп шығару керек.
температуралық коэффициентін, аналитикалық және графикалық түрде активтендіру энергиясын есептеп шығару керек.