Цикл ланцюгових реакцій перетворень хімічних речовин у тропосфері
Гідроксильний радикал не вступає в реакцію з O2, а, головним чином, з СО та СН4 ОН + СО → Н + СО2, (3) ОН + СН4→ СН3 + Н2О. (4) В незабрудненій атмосфері близько 70% ОН реагує з СО і 30% - з СН4.
В присутності третіх речовин М, наприклад молекул O2 або N2, утворюються пероксид радикал HO2 і метилпероксил радикал CH3O2
H + O2 + M → HO2 + M (5)
CH3 + O2 + M → CH3O2 + M (6). Протягом дня метилпероксил радикал CH3O2 вступає в реакцію з оксидом азоту NO CH3O2 + NO = CH3O + NO2 (7) і утворює метоксил радикал CH3O, який далі реагує з киснем, утворюючи формальдегід HCHO CH3O + O2 = HCHO + HO2. (8) Подібно метану молекула формальдегіду окислюється гідроксильним радикалом ОН і в кінцевому результаті перетворюється на СО, СО2 та Н2О. Пероксид радикал HO2 може вступати в реакцію з NO
HO2 + NO → NO2 + OH, (9)
що приводить в кінцевому результаті до утворення азотної кислоти
NO2 + OH +M → HNO3 +M. (10) Таким чином, в представленому матеріалі показано серію ланцюгових реакцій в тропосфері, спричинених окислюючою дією гідроксильного радикала на хімічні речовини природного і антропогенного походження. Цей механізм є основним у виведенні забруднюючих речовин із атмосфери. НО . Приклад Сучасний хімічний склад атмосфери міст характеризується високими концентраціями летких органічних сполук (ЛОС) та суми окислів азоту NOx, які надходять в атмосферу з відпрацьованими газами автомобільних двигунів. Дослідження [Dieter Kley Tropospheric Chemistry and Transport1043 (1997); 276 Science ],, показали, що концентрація гідроксильних радикалів НО . залежить від початкових концентрацій ЛОС та NOx (NO + NO2) на початку реакції та від їх співвідношення R 0 = (ЛОС)0/(NO x)0. Висока концентрація НО . свідчить про успішне протікання окислювальних реакцій та видалення обох цих типів забруднюючих сполук із атмосфери, а також про вторинне утворення НО . . За умови високої концентрації (NO x)0 вміст НО . низький, адже він витрачається на протікання реакцій типу (10). З використанням спеціальної хімічної моделі [Dieter Kley Tropospheric Chemistry and Transport1043 (1997); 276 Science ], було розраховано залежність середньої концентрації НО . за 12 годин від широкого діапазону можливих концентрацій ЛОС та NOx в момент початку реакції їх окислення вільними радикалами початкових в ранковий період (рис).
Fig. 1. Isolines of 12-hour mean concentrations of OH in units of 105 molecules per cubic centimeter for a wide range of initial (VOC)0 and (NO x)0 combinations.A box model (13) and a VOC mix similar to that of Rome (14) were used. The origin of the straight line 1 is at (NOx)0 5 100 parts per billion (ppb) and (VOC)0 5 500 ppb C, representative of initial conditions of polluted city air. Curves 2, 3, and 4 are illustrations of possible trajectories to new initial conditions that result from the simultaneous action, to different degrees, of chemistry and dilution on the trace gas composition. The city can be treated as a point source to consider the effects of dilution of city air with the cleaner environment on the oxidation rates of VOC and NOx and the OH concentration. If spreading of the city plume into the clean surrounding air is fast or if there is no chemistry during the dilution, which happens at night, then, starting for example from a NOx mixing ratio of 100 ppb and an R0 of about 5, the polluted air is diluted as it spreads out, but R0 will not change (5). Any point on the dilution line (curve 1 in Fig. 1) can thus be considered as a new initial value of (VOC)0 and (NOx)0 at the moment at which the chemistry can be activated, for example at daybreak, which would lead to the indicated OH concentrations. However, chemical processes will result in steeper trajectories than that of the dilution line, because the oxidation of NOx by OH proceeds at a faster rate than the oxidation of most VOC in city air. Thus, depending on the relative rates of mixing and dilution of polluted air masses with cleaner background air versus the chemical reaction rates, many points on the OH hypersurface below the dilution line can be reached. Such trajectories are indicated by curves 2, 3, and 4 in Fig. 1. Clearly, dilution and mixing affect the complex nonlinear oxidation chemistry, depending on the relative importance of mixing and dilution compared to the chemical reaction rates.
Atmospheric chemistry is also affected by advective transport, which may import trace species that originated far away. Tropospheric ozone serves as an example. The chemical lifetime of ozone against photolysis- initiated destruction, which leads to OH production, depends on the stratospheric column density of ozone and on the concentration of water vapor (1). In the upper troposphere, the lifetime approaches 1 year, whereas in the boundary layer of the tropics the ozone lifetime is only a few days.
The tropical tropopause is the region
Додаткові матеріали до лекції Таблиця Номенклатура радикалів
Механизм образования кислотных осадков сложный и требует многостороннего подхода. Задача упрощается если рассматривать круговорот отдельных газовых составляющих. Начнем с рассмотрения образования кислотных осадков, связанных с выбросами в атмосферу закиси азота – N2O. (см. также статью "Загрязняющие вещества и смоги"). Закись азота в атмосфере окисляется до окиси азота NO, а затем NO окисляется до NO2. Водяной пар, находящийся в атмосфере, диссоцирует на ионы гидроксила OH и протоны водорода H. Диссоциация может происходить под действием солнечного света с длиной волны l<0,2 мкм. Ионы гидроксила могут образовываться также при окислении водяного пара нечетным кислородом. Образовавшиеся таким образом H и OH взаимодействуют с молекулярным кислородом O2 и тропосферным озоном O3. Результатами этих реакций являются образование пероксидного радикала – OH2. Эти реакции эндотермичны, то есть протекают с выделением тепла (192,5 кДж и 160 кДж) и поэтому требуется третья частица M, которая возьмет на себя отвод высвободившейся в процессе реакций тепловой энергии. В результате взаимодействия OH2 друг с другом образуется перекись водорода H2O2 и молекулярный кислород O2. Перекись водорода может взаимодействовать с NO и NO2, продуктами этих реакций будут азотистая кислота HNO2 и азотная кислота HNO3. Но наиболее существенными процессами являются взаимодействие пероксидного радикала OH2 или гидроксила OH с оксидом NO или диоксидом азота NO2 в присутствии третьей частицы. Продуктом этих реакций является азотная кислота HNO3, а сами реакции идут на несколько порядков быстрее, чем реакции NO и NO2 с перекисью водорода H2O2. Помимо этих реакций, в статье "Загрязняющие вещества и смоги" мы упоминали о том, что азотная кислота также может образовываться из N2O5 и водяного пара. Ещё одним способом образования азотистой и азотной кислотой являются реакции NO и NO2 с метилпероксидом – CH3O2. Кроме этого, продуктом этих реакций также является вредный для человека формальдегид. Метилпероксид CH3O2 в атмосфере образуется в процессе окисления метана кислородом воздуха. Метан попадает в атмосферу вследствие деятельности микроорганизмов (бескислородное брожение) в виде так называемого "болотного газа". Конечным продуктом окисления метана в атмосфере является углекислый газ и водяной пар.
Хімічними процесами в тропосфері керують реакції з гідроксильним радикалом. Гідроксильний радикал складається з одного атома кисню і одного атома водню, які хімічно зв'язані в двоатомній молекулі. Кисень приносить до гідроксильного радикала вісім електронів (шість у валентних орбіталях), а водень - один електрон. Таким чином, в гідроксильному радикалі є непарне число електронів (дев'ять), тому гідроксильний радикал завжди матиме непарний електрон. Цей непарний електрон зазвичай асоціюється з атомом кисню, тому у формулах, його позначають крапкою, розміщуючи біля кисню, як показано нижче:
|



 O
O-O
O
O-O

 метанол
метанол
 радикал метанолу
радикал метанолу
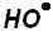 .
.


