
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Системні виклики sendto і recvfrom
Дата добавления: 2015-09-18; просмотров: 769
|
|
Дәріс тезистері:1893 жылы А.Вернердің координациялық теориясына сәйкес комплексті қосылыстың молекулалары орталық атомнан (комплекс түзуші) және онымен байланысқан лигандтардан (зарядталған немесе нейтралды анорганикалық немесе органикалық бөлшектер, яғни иондар немесе молекулалар) тұрады.
Комплексті қосылыстардың кұрылысы өте күрделі. Сулы ерітінділерде комплексті объектілер комплекс түзуші мен лигандтардың электронды орбиталдары арасындағы өзара әрекеттесуі нәтижесінде түзіледі. Лигандтарда бөлінбеген электрондар жұбы болады, ол жұпты комплекс түзуші өзінің бос орбиталіне қабылдайды. Электронды жұп ортақ болып, нәтижесінде комплекс түзуші мен лиганд арасында донорлы-акцепторлы деп аталатын химиялық байланыс түзіледі.
Сапалық және сандық анализде комплекс түзілу реакциялары өте жиі қолданылады. 1893 жылы А.Вернердің координациялық теориясына сәйкес комплексті қосылыстың молекулалары ішкі координациялық сферамен бірге сыртқысын да түзетін иондар немесе молекулалардан тұрады. Ішкі сферасының ортасында бір не бірнеше орталық атомдар (иондар) бар, оларды комплекс түзушілер деп атайды және көбінесе М әрпімен белгілейді. Оларды айнала қарама-қарсы зарядты иондар немесе полюсті молекулалар топтасады, олар лигандтар деп аталады және L әрпімен белгіленеді.
Негізгі [1-3], Қосымша [4-11]. Мерзімдік әдебиеттер [12-14]
Электрондық оқулықтар мен оқу құралдары [15-16]
Интернет көздері [17-20]
Дәріс тақырыбы: Комплексті қосылыстардың ерітіндідегі тепе-теңдік. Комплексті қосылыстардың тұрақтылық константалары (сатылы және жалпы).
Дәріс тезистері:Ерітіндідегі комплекстердің түзілуі және диссосациялануы жалпы түрде былай жазылады:
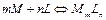
бұл тепе-теңдіктің констансасы 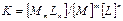 түзілу константасы немесе тұрақтылық констансасы деп аталады3. Бұған қарама-қарсы шаманы тұрақсыздық константасы деп атайды. Тұрақтылық констансасының сан мәні қанша үлкен болса тұрақсыздық константасының сан мәні сонша кіші, ал комплексті қосылыстардың сонша көп мөлшері ерітіндіде болады. Комплексті қосылыстар аз диссосацияланады.
түзілу константасы немесе тұрақтылық констансасы деп аталады3. Бұған қарама-қарсы шаманы тұрақсыздық константасы деп атайды. Тұрақтылық констансасының сан мәні қанша үлкен болса тұрақсыздық константасының сан мәні сонша кіші, ал комплексті қосылыстардың сонша көп мөлшері ерітіндіде болады. Комплексті қосылыстар аз диссосацияланады.
Комплексондар - көпнегізді аминокарбонқышқылдары. Мысалы: 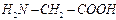 . Металл иондарының комплексондармен түзген комплексті қосылысы комплексонаттар деп аталады.
. Металл иондарының комплексондармен түзген комплексті қосылысы комплексонаттар деп аталады.
Комплексті қосылыстарды атау барысында оның лигандаларының аталуына басты назар аударылады. Теріс зарядты лигандалар сол ион атауына «о» әрпін қосу арқылы жасалады. Бейтарап молекулалар үшін дәстүрлі кең тараған атаулары пайдаланылады.
Мысалы: 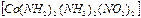 - динитритотетраамин кобальт (II),
- динитритотетраамин кобальт (II), 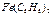 - бис (циклопентадиенил) темір. Комплекс түзуші атомдар өзара тікелей байланысып келген көпядролы қосылыстар кластерлер деп аталады. Қарапайым кластерлер формуласы
- бис (циклопентадиенил) темір. Комплекс түзуші атомдар өзара тікелей байланысып келген көпядролы қосылыстар кластерлер деп аталады. Қарапайым кластерлер формуласы  . Мысалы:
. Мысалы: 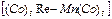 - пентакарбонил марганец – пентакарбонил рений.
- пентакарбонил марганец – пентакарбонил рений.
Координация орталығы жоқ қосылыстар да белгілі. Мысалы, органикалық қосылыстар гидрохинон 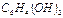 және хинон
және хинон 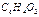 олардың p - электрондары есебінен хингидрон комплексті қосылысын түзе әрекеттеседі. «Координациялық қосылыстардан» гөрі «Комплексті қосылыстар» ұғымы кеңдеу болуына қарамастан, оларды тәжірибеде онша бөліп қарамайды.
олардың p - электрондары есебінен хингидрон комплексті қосылысын түзе әрекеттеседі. «Координациялық қосылыстардан» гөрі «Комплексті қосылыстар» ұғымы кеңдеу болуына қарамастан, оларды тәжірибеде онша бөліп қарамайды.
Сондай-ақ комплексті қосылыстарды қос тұздардан ажырата білу қажет, себебі олар тек қана физико-химиялық қасиеттерімен емес, сонымен бірге құрылысымен де ерекшеленеді.
Комплексті тұздар жай және комплексті иондарға диссосацияланады, соңғысы жай иондарға өте аз мөлшерде диссосацияланады: 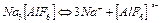
Комплексті ион бейтарап, оң және теріс зарядталған болуы мүмкін. Ішкі координациялық сфераның заряды зарядталған иондардың алгебралық қосындысына тең, мысалы 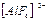 ионы үшін (3+)+(-6)=-3.
ионы үшін (3+)+(-6)=-3.
Иондық сипаттағы комплексті қосылыстарда сыртқы сфера түзіледі, мысалы 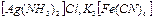 . Бейтарап комплекстерде, мысалы
. Бейтарап комплекстерде, мысалы 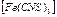 сыртқы сфера болмайды. Ішкі координациялық сферада болатын лигандтар саны комплекс түзушінің координациялық санын көрсетеді, ол 2, 3, 4, 5, 6, 8 тең. Мысалы
сыртқы сфера болмайды. Ішкі координациялық сферада болатын лигандтар саны комплекс түзушінің координациялық санын көрсетеді, ол 2, 3, 4, 5, 6, 8 тең. Мысалы 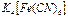 қосылысында ішкі сфера
қосылысында ішкі сфера 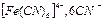 лигандалар бар, ал сыртқы координациялық сферасы
лигандалар бар, ал сыртқы координациялық сферасы 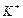 катионы.
катионы.
Лиганданың комплекстүзуші атоммен байланыс түзу санына қарай комплексті қосылыстар екіге бөлінеді. Комплекс түзуші атоммен әр лиганд тек бір ғана байланыс түзетін болса, мұндай қосылыстар монодентантты комплекстер деп аталады. Мысалы: 
Комплекстүзуші атоммен лигандалары екі және одан да көп байланыс түзетін қосылыстар полидентантты комплекстер деп аталады. Лигандтары қышқыл қалдықтары болып келетін комплекстер ацидокомплекстер деп аталады. Мысалы: 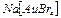 .
.
Егер лигандтар бірнеше атомдардан тұрса, кей жайдайларда комплекс түзуші лигандтың екі немесе бірнеше атомымен байланысатын болса, ондай лигандтар полидентантты, ал түзілген комплекстер хелаттар деп аталады. Хелаттардың негізгі ерекшелігі- құрамында комплекс түзуші бар және лигандтардан тұратын циклдер. Хелаттар түзуге көбінесе комплексондар бейім. Комплексондар - көпнегізді аминокарбонқышқылдары. Мысалы: 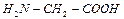 . Металл иондарының комплексондармен түзген комплексті қосылысы комплексонаттар деп аталады.
. Металл иондарының комплексондармен түзген комплексті қосылысы комплексонаттар деп аталады.
Комплексті қосылыстардың бірнеше координациялық орталықтары болуы мүмкін. Ондай қосылыстарды көп ядролы комплексті қосылыстар деп атайды.
Негізгі [1-3], Қосымша [4-11]. Мерзімдік әдебиеттер [12-14]
Электрондық оқулықтар мен оқу құралдары [15-16]
Интернет көздері [17-20]
| <== предыдущая лекция | | | следующая лекция ==> |
| Теоретичні відомості | | | Організація зв'язку між процесами за допомогою установки логічного з'єднання |