
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Контакт оратора зі слухачами
Дата добавления: 2015-08-30; просмотров: 713
|
|
Парциальное давление пара каждого компонента для идеальных жидких смесей зависит от температуры и пропорционально мольной доли данного компонента в жидкости (закон Рауля):
рнкк = Рнкк * х (1)
рвкк = Рвкк * (1 – х) (2)
где рнкк и рвкк - парциальные давления низкокипящего и высококипящего компонентов, Па;
Рнкк и Рвкк - упругость, или давление насыщенных паров над чистыми компонентами, Па;
х - содержание низкокипящего компонента в жидкости, мольн. доли.
Общее давление пара над жидкостью равно сумме парциальных давлений (закон Дальтона):
Р = рнкк + рвкк = Рнкк * х + Рвкк * (1 – х) (3)
Решая это уравнение относительно х, получаем:
х = (Р – Рвкк)/(Рнкк – Рвкк) (4)
Парциальное давление компонента можно получить по закону Дальтона:
рнкк = Р*ункк или Рнкк*х = Р*ункк (5)
где ункк - содержание низкокипящего компонента в парах, мольн. доли.
При совместном решении уравнений (1) и (5) можно получить равновесный состав пара:
ункк = рнкк /Р = Рнкк *х/(Рнкк * х + Рвкк * (1 – х)) = α*х/(1+(α – 1)*х, (6)
где α – относительная летучесть НКК.
При решении приведенных уравнений строятся следующие графики:
а) изобара равновесных составов, называемая кривой равновесия, определяющая равновесные составы пара и жидкости при постоянном давлении (рисунок 2);
б) изобары температур кипения и конденсации, определяющие температуру кипения жидкости и температуру конденсации паров заданного состава (рисунок 3).
Для построения этих графиков необходимо задаться рядом температур, лежащих между температурами кипения чистого бензола (80,1°С) и чистого о-ксилола (144,4°С).
Давление паров отдельных компонентов при заданных температурах находится по уравнению Антуана
lg P = A – B/(C + t), (7)
где Р – давление паров над чистым компонентом при какой-то температуре, мм рт.ст.;
t – температура, 0С;
А, В, С – эмпирические константы.
Таблица 1 – Значения констант А, В, С
| Соединение | А | В | С |
| Бензол | 6,91 | ||
| О-ксилол | 7,0 |
 Рисунок 2 – Диаграмма равновесия составов пар-жидкость
Рисунок 2 – Диаграмма равновесия составов пар-жидкость
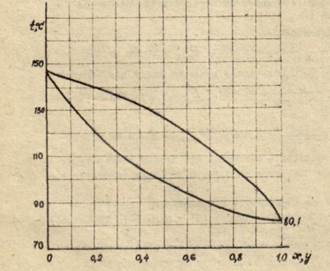 Рисунок 3 – Изобары компонентов
Рисунок 3 – Изобары компонентов
При температуре 80,1 0С давление паров бензола равняется 760 мм рт.ст.
Давление паров о-ксилола при температуре 80,1 0С по формуле (7):
lg Pо-к = 7 + 1475/(214 + 80,1) = 1,978. Pо-к = 95 мм рт.ст.
При температуре 90 0С давление паров бензола равняется
lg Pбен = 6,91 + 1214/(221 + 90) = 3,0083. Pбен = 1020 мм рт.ст.
lg Pо-к = 7 + 1475/(214 + 90) = 1,138. Pо-к = 137,4 мм рт.ст.
Давления паров бензола и о-ксилола при других температурах в указанном интервале находятся аналогично и данные заносятся в таблицу 2.
Таблица 2 – Расчет равновесия смеси бензол – о-ксилол
| t, 0C | Рнкк, мм рт.ст. | Рвкк, мм рт.ст. | х (формула 4),мольн.доли | у (формула 5),мольн.доли |
| 80,1 | 96,54 | |||
| 876,35 | 116,65 | 0,847 | 0,977 | |
| 140,61 | 0,708 | 0,946 | ||
| 1170,11 | 168,48 | 0,591 | 0,909 | |
| 1342,98 | 200,7 | 0,49 | 0,865 | |
| 1534,88 | 237,78 | 0,403 | 0,813 | |
| 1747,13 | 280,24 | 0,327 | 0,752 | |
| 1981,09 | 328,64 | 0,261 | 0,68 | |
| 2238,12 | 383,56 | 0,203 | 0,6 | |
| 2519,59 | 445,62 | 0,152 | 0,51 | |
| 2826,9 | 515,48 | 0,106 | 0,393 | |
| 3161,46 | 593,8 | 0,065 | 0,269 | |
| 3524,68 | 681,29 | 0,0277 | 0,128 | |
| 144,4 | 3869,13 |
По упругости паров компонентов при различных температурах находятся равновесные составы: жидкости формула (4) и пара формула (6), причем общее давление берётся Р = 760 мм рт.ст.
Определяем состав смеси, дистиллята и кубового остатка в мольных долях по низкокипящему компоненту по уравнению
х = хнкк/Мнкк/( хнкк/Мнкк + (1 - хнкк)/Мвкк) (8)
Пересчитаем по формуле (8) в мольные доли:
1)исходное питание хF = 0,45/78/(0,45/78 + (1 – 0,45/106) = 0,527;
2)дистиллят хР = 0,918/78/(0,918/78 + (1 – 0,918/106) = 0,95;
3)кубовый остаток xW = 0,0175/78/(0,0175/78 + (1 – 0,0175/106) = 0,021.
На основании расчетных данных строятся изобары равновесия х – у (см. рисунок 2) и изобары температуры кипения и конденсации (см. рисунок 3).
| <== предыдущая лекция | | | следующая лекция ==> |
| Розділ 4. Прийоми маніпулювання в суперечках | | | Особливості аудиторії |