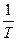Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Білет №1 Поняття та ознаки держави.
Дата добавления: 2015-10-15; просмотров: 622
|
|
Коэффициент преломления, как уже отмечалось, зависит от поляризуемости атомов, молекул и ионов. Поэтому исследование электрических характеристик вещества даёт важную информацию о распределении зарядов в молекуле и позволяет установить некоторые свойства вещества, обусловленные его электрической асимметрией.
Рассмотрим некоторые вопросы, касающиеся природы возникновения дипольного момента в молекуле.
Любая молекула представляет собой совокупность положительно заряженных ядер и отрицательно заряженных электронов. При суммарном заряде ядра, равном +е, заряд всех электронов будет равен –е .
Если распределение ядер и электронов в пространстве таково, что центры «тяжести» положительных и отрицательных зарядов не совпадают, то молекула обладает постоянным дипольным моментом:
μ =е∙l, (12)
где l – расстояние между центрами электрических зарядов.
Такая молекула является полярной. Мерой полярности молекулы служит величина дипольного момента, которую выражают в дебаях (D):
D = 3,33564·10−30 Кл·м
Дипольный момент – величина векторная. Направление вектора «→» выбирается от отрицательного полюса к положительному. В химической литературе, однако, традиционно принимается противоположное направление, т. е. от «+» к «−».
Если в двухатомных молекулах простых веществ, т. е. состоящих из одинаковых атомов, и в многоатомных молекулах сложных веществ, обладающих высокой симметрией, центры «тяжести» разноимённых электрических зарядов совпадают (l = 0), то такие молекулы не обладают постоянным дипольным моментом (μ = 0) и являются неполярными.
Если любую неполярную молекулу поместить в постоянное электрическое поле, создаваемое, например, конденсатором, то происходит её поляризация, выражающаяся в разнонаправленном смещении зарядов (деформационная поляризация). Тяжёлые ядра атомов будут несколько смещаться в сторону отрицательного полюса, а электроны незначительной массой будут легко смещаться в сторону положительного полюса. В результате центры «тяжести» положительных и отрицательных зарядов совпадать не будут, и в молекуле будет возникать индуцированный (наведённый) диполь, момент которого пропорционален напряжённости электрического поля:
μинд = αD∙Е, (13)
где Е – напряжённость внутреннего электрического поля в молекуле [эл. ст. ед./см2; Кл/см2]
αD – коэффициент пропорциональности, который показывает, какой дипольный момент создается при напряжённости электрического поля, равной единице. Чем больше αD, тем легче поляризуется молекула. Коэффициент αD, называемый деформационной поляризуемостью, равен сумме электронной (αD) и атомной поляризуемости (αат):
αD = αэл + αат (14)
Чем дальше удалены внешние (более подвижные) валентные электроны от атомных ядер, тем выше электронная поляризуемость молекулы. Так как смещение атомных ядер незначительно (αат составляет 5 – 10 % от αэл ) и им можно пренебречь, то приближённо будет иметь место выражение:
αD = αэл.
Таким образом, в электрическом поле образуется диполь снаведённым или как его называют индуцированным дипольным моментом.
Если любую полярную молекулу поместить в электрическое поле, то будут происходить два процесса. Во-первых, молекула будет ориентироваться вдоль поля, и, во-вторых, расстояние между центрами тяжести зарядов будет увеличиваться, увеличивая дипольный момент молекулы.
Таким образом, полярные молекулы в электрическом поле так же, как и неполярные испытывают деформационную поляризацию. Кроме того, под влиянием электрического поля они ориентируются вдоль его силовых линий, стремясь принять устойчивое положение, отвечающее минимуму потенциальной энергии. Это явление, называемое ориентационной поляризацией, даёт эффект, эквивалентный увеличению поляризуемости молекулы на величину αор, называемую ориентационной поляризуемостью: 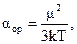 (15)
(15)
где k – постоянная Больцмана (1,380662(44)∙10−23 Дж/К);
Т – абсолютная температура, К.
Таким образом, полная поляризуемость молекулы α складывается из трёх величин: α = αэл + αат + αор или α = αD + αор (16)
Из уравнений (11) и (12) следует, что полная поляризуемость α будет иметь размерность объёма [см3 или Å3].
В электрическом (электромагнитном) поле молекулы поляризуются и возникает состояние напряжённости, характеризуемое величиной диэлектрической проницаемости (ε) вещества, которая входит в уравнение закона Кулона и может быть определена экспериментально.
Измеряя диэлектрическую проницаемость, характеризующую вещество в целом, можно определить по теории поляризации диэлектриков электрооптические параметры его молекул, связанные с диэлектрической постоянной формулой Клаузиуса-Моссотти:
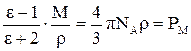 , (17)
, (17)
где NA – число Авогадро;
М – молярная масса вещества;
ρ – плотность вещества, г/мл;
РМ – молярная поляризация – величина, характеризующая меру индуцированного момента в объёме, который занимает 1 моль вещества.
Молярная поляризация, дипольный момент и общая поляризуемость молекулы связаны друг с другом уравнением Дебая, которое выводится из уравнений (12) – (14):
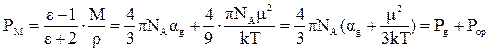 (18)
(18)
По уравнению Дебая можно вычислить значения α и μ по известным величинам ε, М и ρ.
Поляризация молекул веществ, имеющих сравнительно большие значения ε и Р (например Н2О, HCN, HCl), зависит от температуры, уменьшаясь при её повышении. Молекулы таких веществ, не имея центра симметрии зарядов, являются постоянными диполями. Для них молярная поляризация в уравнении Дебая выражается линейной функцией от 1/Т:
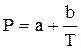 , где
, где 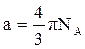 и
и 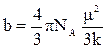 . (19)
. (19)
|
|

|
|
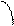




|
|
| |

Рис. 3. Зависимость молярной поляризации от обратной температуры
а – для молекулы, постоянных диполей; b – для неполярных молекул.
Вещества с μ = 0 состоят из симметричных молекул (например О2, СО2, СS2, молекулы многих углеводородов). В электрическом поле в таких молекулах возникает индуцированный дипольный момент. Поляризация молекул этого типа не зависит от температуры (рис. 3).
Для случая молекул постоянных диполей (прямая а; рис. 3) отрезок ординаты ОА = а определяет величину поляризуемости α, а tgβ = b – величину дипольного момента μ
Полная поляризация молекул может наблюдаться или в статическом электрическом поле, или в электромагнитном поле низкой частоты, но не в поле высокой частоты, где диполи не успевают ориентироваться. Поэтому, например, в поле низкочастотного инфракрасного излучения происходит и электронная, и атомная поляризация, а в более высокочастотном поле видимого света – только электронная поляризация (Рэл = 4/3πNАαэл), т.к. при высокочастотных колебаниях успевают смещаться только очень лёгкие частицы – электроны. Для неполярных веществ: РОР = 0 и Р = РД ≈ РЭЛ.
| <== предыдущая лекция | | | следующая лекция ==> |
| РОЗДІЛ V. ВИВЧЕННЯ МАРКЕТИНГОВОЇ ДІЯЛЬНОСТІ ГОСПОДАРСТВА. | | | Білет №3 Риси, що відрізняють державну організацію від організації первісного суспільства. |