I. Сформулируйте закон или дайте определение.Нестационарный процесс –плотность потока тепла постоянно меняется. Нестационарный перенос тепла теплопроводностью описывается дифференциальным законом Фурье: Cd∂T / ∂t) = δ (λ δ T) + qv, где где C - удельная теплоемкость; d - плотность; qv - объемная плотность потока тепла от внутренних источников; t - время. При независящих от температуры свойствах C, d и l выражение может быть переписано так:
∂T / ∂t) = a δ2T + (qv / Cd), где a = λ / Cd - коэффициент температуропроводности, характеризующий скорость распространения тепла в веществе.
I. Сформулируйте закон или дайте определение. 1. Статистический и термодинамический методы исследования вещества. Статический метод – метод, которые изучают законы поведения огромного числа молекул, основанные на том, что свойства макроскопической системы, в конечном счете, определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии и т. д.). Термодинамика ничего не говорит о микроскопическом строении вещества, о механизме явлений, а лишь устанавливает связи между макроскопическими свойствами вещества. Молекулярно-кинетическая теория и термодинамика взаимно дополняют друг друга, образуя единое целое, но отличаясь различными методами исследования. 2. Основные положения молекулярно-кинетической теории. А) Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы. Б) Атомы и молекулы находятся в непрерывном хаотическом движении. С) Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
3. Максвелловский закон распределения молекул газа по их скоростям. Закон распределения молекул по скоростям Максвелла описывает стационарное распределение молекул однородного одноатомного идеального газа по скоростям в условиях термодинамического равновесия и отсутствия внешнего силового поля. 4. Больцмановский закон распределения молекул газа по их энергиям. При постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул. Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести. 5. Закон равномерного распределения энергии по степеням свободы молекул газа. На каждую степень свободы приходится энергия, Е=Т*к/2 Т - температура в Кельвинах к - постоянная Больцмана Для атома движение в трёхмерном пространстве имеет три степени свободы для молекулы двухатомного газа уже пять или Закон равномерного распределения энергии по степеням свободы заключается в том, что в системе, имеющей большое число степеней свободы (например, состоящей из большого числа двигающихся независимо одна от другой молекул газа), на каждую степень свободы приходится в среднем одна та же доля энергии. 6. Молекулярно-кинетическое толкование абсолютной температуры. Абсолютная температура-мера средней кинетической энергии молекул.
7. Первое начало термодинамики. Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы над внешними телами: Q = ΔU + A. 8. Адиабатический процесс. Термодинамический процесс, происходящий в системе без теплообмена с окружающей средой, т. е. в адиабатически изолированной системе, состояние которой можно изменить только путём изменения внешних параметров. 9. Политропические процессы. Термодинамические процессы, во время которых удельная теплоёмкость газа остаётся неизменной. 10. Второе начало термодинамики. Невозможны такие процессы, единственным конечным результатом которых явилось бы отнятие от некоторого тела определенного количества тепла и превращения этого тепла полностью в работу.
II. Запишите ответ, дайте обоснование ответа, приведите рисунок. 1. Изопроцессы. Запишите уравнения состояния идеального газа для этих процессов и начертите их графики в координатах P и V, P и Т, Т и V. Изотермический процесс (T = const) pV = const
Изохорный процесс (V = const) p/Т = const
Изобарный процесс (p = const) V/Т = const
2. Дайте определение полной, молярной и удельной теплоемкостей газа. Полная теплоемкость газа - отношение количества теплоты, сообщенного газу, к изменению температуры, которое при этом произошло. Молярная теплоемкость газа - количество теплоты, необходимое для нагревания 1 моля газа на 1 градус. Удельная теплоёмкость газа - количество теплоты, необходимое для нагревания единицы массы газа на 1 градус.
3. Дайте определение равновесного и неравновесного состояния системы. Равновесным является такое состояние системы, при котором действие процессов внутри системы приводит к её выходу из равновесия, полностью компенсируется противодействием процессов, идущих во внешней среде. Неравновесное состояние, это при котором в системе происходит или может в любой момент начаться одностороннее направленное изменение её параметров может вследствие несоответствия их с параметрами состояния среды. 4. Дайте определение обратимого и необратимого процесса. Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений. Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния.
5. Дайте определение кругового процесса (цикла). Объясните принцип действия тепловых машин. Круговой процесс (цикл) - процесс, при котором физическая система (например, пар), претерпев ряд изменений, возвращается в исходное состояние. Любой тепловой двигатель (паровые и газовые турбины, двигатели внутреннего сгорания) состоит из трех основных элементов: рабочего тела (это газ), которое совершает работу в двигателе; нагревателя, от которого рабочее тело получает энергию, часть которой затем идет на совершение работы; холодильника, которым является атмосфера или специальные устройства (см. рис.). Ни один тепловой двигатель не может работать при одинаковой температуре его рабочего тела и окружающей среды. Обязательно температура нагревателя больше температуры холодильника. При совершении работы тепловыми двигателями происходит передача теплоты от более горячих тел к более холодным. Рабочее тело двигателя получает количество теплоты QН от нагревателя, совершает работу A' и передает холодильнику количество теплоты QХ. В соответствии с законом сохранения энергии А' < QН - QХ. В случае равенства речь идет об идеальном двигателе, в котором нет потерь энергии.
6. Начертите цикл Карно в координатах P и V. Приведите теорему Карно.
А) Коэффициент полезного действия любой обратимой тепловой машины, работающей по циклу Карно, не зависит от природы рабочего тела и устройства машины, а является функцией только температуры нагревателя
Б) Коэффициент полезного действия любой тепловой машины, работающей по необратимому циклу, меньше коэффициента полезного действия машины с обратимым циклом Карно, при условии равенства температур их нагревателей и холодильников:
7. Дайте определение энтропии. Чему равно изменение энтропии для обратимых и необратимых процессов. Энтропия - функция состояния термодинамической системы. Для обратимых процессов изменение энтропии равно 0. Для необратимых процессов энтропия возрастает.
9. Начертите графики изопроцессов в координатах Т и S. Получите формулы для подсчета изменения энтропии идеального газа для изопроцессов.
10. Начертите цикл Карно в координатах Т и S. Приведите теорему Карно.
Первая теорема Карно. КПД обратимого цикла Карно, осуществляемого между двумя источниками теплоты, не зависит от свойств рабочего вещества, с помощью которого этот цикл осуществляется. Вторая теорема Карно. КПД необратимого цикла Карно всегда меньше обратимого цикла Карно, осуществляемого между одними и теми же источниками теплоты, имеющими постоянные, но разные температуры.
|





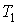 и холодильника
и холодильника  :
: ;
;
 .
.
 т.к.
т.к.  ;
;  , т.к.
, т.к.  ;
; т.к. Р1 = Р2;
т.к. Р1 = Р2;




