ТЕМА 11. ЭЛЕКТРОЛИЗ.Электролизом называется совокупность окислительно-восстановительных процессов, протекающих на электродах при прохождении постоянного электрического тока через расплавы или растворы электролитов, в результате которых происходит превращение электрической энергии в химическую. Ячейка для электролиза (электролизер) состоит из двух электродов, погруженных в расплав или раствор электролита. При электролизе электрод, на котором протекает реакция восстановления (катод), подключен к отрицательному полюсу внешнего источника постоянного тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу постоянного источника тока. При прохождении тока через расплав или раствор электролита катионы электролита под действием электрического поля движутся к катоду и восстанавливаются, анионы перемещаются к аноду и окисляются. Из возможных процессов будет протекать тот, для которого затраты энергии минимальны. На катоде будут восстанавливаться прежде всего те компоненты, которые имеют наибольший электродный потенциал, а на аноде будут, окислятся компоненты с наименьшим электродным потенциалом. Материал электродов в определенных условиях также может участвовать в процессах электрохимического окисления - восстановления. В водных растворах, кроме ионов самого электролита, находятся также молекулы воды, способные восстанавливаться на катоде и окисляться на аноде, а также ионы Н+ и ОН-, относительная концентрация которых определяется величиной рН среды. При электролизе растворов электролитов возможно протекание конкурирующих реакций с участием молекул воды, ионов Н+ и ОН-. Критерием, определяющим преимущество того или иного электрохимического процесса, как уже отмечалось служит величина стандартного электродного потенциала соответствующих равновесных систем. Чем выше потенциал, тем легче восстанавливается окисленная форма системы, а чем он ниже, тем легче окисляется восстановленная форма. Характер катодного процесса при электролизе водных растворов определяется, прежде всего, положением соответствующего металла в ряду напряжений. При электролизе в общем случае на катоде происходит процесс восстановления катионов металлов, находящихся в растворе Men+ + nē = Мeо. Чем больше величина электродного потенциала металла В водном растворе электролита на катоде может также происходить восстановление ионов водорода или молекул воды по схеме:
Реальный электродный потенциал восстановления водорода на катоде, с учетом перенапряжениявыделения водорода на металлах, составляет При рассмотрении анодных процессов следует иметь в виду, что материал анода может быть инертным веществом (графит, уголь, платина, сплавы платиновых металлов), не претерпевающим анодного окисления, или активным (из специально подобранного неплатинового металла), подвергающимся окислению в ходе электролиза. В связи с этим различают электролиз с инертным анодом и электролиз с активным (растворимым) анодом. При электролизе водных растворов солей на аноде могут проходить процессы окисления молекул воды или окисление бескислородных анионов солей. Реальный электродный потенциал выделения кислорода из раствора составляет · Аn- - nē = А, · в кислой и нейтральной среде (рН£7) 2H2O - 4е= = О2+4H+ , · в щелочной среде (pH>7) 4ОH-- 4е= = О2+2H2O. Чем меньше величина окислительно-восстановительного потенциала вещества При теоретическом выборе схемы электролиза, когда нет возможности вычислить напряжение разложения электролита, следует руководствоваться следующими правилами разрядки катионов и анионов при электролизе водных растворов:
Процессы на катоде: 1. На катоде в первую очередь восстанавливаются катионы металлов с более высокими электродными потенциалами (более сильные окислители), имеющие стандартный электродный потенциал больший, в чем у водорода. 2. Если металл находится в начале электрохимического ряда напряжений до Ti включительно ( 3. Катионы металлов, имеющие стандартный электродный потенциал меньший, чем у водорода (
Процессы на аноде: 1. На инертном аноде в первую очередь окисляются анионы бескислородных кислот в порядке возрастания значений их стандартных потенциалов в ряду Cl-, Br-, I-; при электролизе водных растворов, содержащих анионы кислородсодержащих кислот ( 2. При электролизе водных растворов активный (не инертный) металлический анод окисляется по схеме Meо - nē = Мen+
Количественная характеристика электролиза выражается двумя законами Фарадея: 1. При электролизе различных химических соединений равные количества электричества выделяют на электродах массы вещества, пропорциональные молярным массам их эквивалентов: nЭК (В1)(анод) = nЭК (В2)(катод).
2. Масса вещества выделяющегося на электродах или разлагающегося при электролизе прямо пропорциональна количеству прошедшего через электролит электричества:
где mв – масса вещества, выделяющегося на электродах, г;
τ – время электролиза, сек (час); F – постоянная Фарадея, равная 96500 Кл/моль, если τ – c, и 26,8 А·ч/моль, I – сила тока, А.
Если выделяющиеся вещества находятся в газообразном состоянии, то второй закон электролиза можно записать в виде:
где V0 (B) – объем газообразного вещества при н.у., л; VМэк (В) – объем молярной массы эквивалента газообразного вещества, л/моль. Для водорода VМэк (Н) =11,2 л/моль, для кислорода VМэк (0)= 5,6 л/моль, для хлора VМэк (Cl)= 11,2 л/моль. Отношение массы вещества, фактически выделившегося на электродах (
Таблица 11.1
|

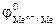 , тем более сильными окислительными свойствами обладает ион Men+, и тем при более низком напряжении, т.е. раньше, начинается восстановление катионов металла.
, тем более сильными окислительными свойствами обладает ион Men+, и тем при более низком напряжении, т.е. раньше, начинается восстановление катионов металла. = -(1,2…1,4) В. Поэтому из водных растворов электролитов могут восстанавливаться катионы только тех металлов, для которых
= -(1,2…1,4) В. Поэтому из водных растворов электролитов могут восстанавливаться катионы только тех металлов, для которых 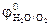 = +(1,5…1,9)В. Поэтому при электролизе водных растворов на инертном аноде могут окисляться только анионы бескислородных кислот (Cl-, Br- и др.), для которых потенциал выделения ниже, чем потенциал выделения кислорода. Анионы кислородосодержащих кислот (
= +(1,5…1,9)В. Поэтому при электролизе водных растворов на инертном аноде могут окисляться только анионы бескислородных кислот (Cl-, Br- и др.), для которых потенциал выделения ниже, чем потенциал выделения кислорода. Анионы кислородосодержащих кислот (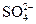 ,
, 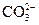 ,
,  ,
,  и др.) имеют более высокий окислительно-восстановительный потенциал, чем потенциал выделения кислорода из воды, и, следовательно, в водных растворах окисляться на анодах не могут. Если анод инертный (С, Pt, Au), то на аноде в первую очередь окисляются анионы бескислородных кислот (Аn-=Cl-, Br- и др.), затем гидроксид ионы ОН- и, в последнюю очередь, молекулы воды:
и др.) имеют более высокий окислительно-восстановительный потенциал, чем потенциал выделения кислорода из воды, и, следовательно, в водных растворах окисляться на анодах не могут. Если анод инертный (С, Pt, Au), то на аноде в первую очередь окисляются анионы бескислородных кислот (Аn-=Cl-, Br- и др.), затем гидроксид ионы ОН- и, в последнюю очередь, молекулы воды:
 , тем более сильными восстановительными свойствами оно обладает, и тем при более низком напряжении, т.е. раньше, начинается окисление этого вещества на аноде. Схема протекания анодных процессов на инертных и активных анодах представлена в таблице 11.1.
, тем более сильными восстановительными свойствами оно обладает, и тем при более низком напряжении, т.е. раньше, начинается окисление этого вещества на аноде. Схема протекания анодных процессов на инертных и активных анодах представлена в таблице 11.1. =-1,63В) и соответственно, до
=-1,63В) и соответственно, до  и др.), окисляются только молекулы воды (при рН£7) или ОH- ионы (при pH>7).
и др.), окисляются только молекулы воды (при рН£7) или ОH- ионы (при pH>7). ( 11.1)
( 11.1)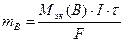 ,(11.2)
,(11.2) – молярная масса эквивалента вещества, г/моль;
– молярная масса эквивалента вещества, г/моль; (11.3)
(11.3) ), к теоретически возможному (
), к теоретически возможному ( ) называется выходом по току (ВТ):
) называется выходом по току (ВТ): (11.4)
(11.4)


