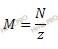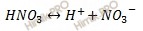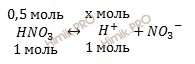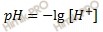Решение задачи. Решим задачу, используя закон разбавления Оствальдав его приближенном варианте, который выражается формулой:Решим задачу, используя закон разбавления Оствальдав его приближенном варианте, который выражается формулой:
где: α – степень диссоциации; K – константа диссоциации; C– молярная концентрация электролита. Найдем молярную концентрацию раствора азотной кислоты (HNO3) по формуле, устанавливающей связь между нормальной и молярной концентрацией:
Где: N – нормальная концентрация; M – молярная концентрация; z – число эквивалентности. Откуда молярная концентрация равна:
Учитывая, что число эквивалентности азотной кислоты (HNO3) равно 1 (число атомов водорода в молекуле кислоты), рассчитаем молярную концентрацию раствора азотной кислоты (HNO3): M (HNO3) = 0,5 (моль/л). Определим константу диссоциации азотной кислоты (HNO3):
Степень диссоциации переводим из процентов в доли единицы. Запишем уравнение диссоциации азотной кислоты (HNO3):
Учитывая, что раствор азотной кислоты (HNO3) 0,5 M, по уравнению диссоциации вычислим, сколько моль ионов водорода H+ образуется при полной диссоциации 0,5 моль азотной кислоты (HNO3):
при диссоциации 1 моль HNO3 образуется 1 моль ионов H+ при диссоциации 0,5 моль HNO3 образуется моль ионов H+ Откуда:
Напомню, молярная концентрация – число молей вещества содержащегося в единице объема раствора. Следовательно, концентрация ионов водорода равна: [H+] = 0,5 (моль/л). Вычислим pH раствора по формуле:
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе. Получаем: pH = – lg 0,5 = 0,3 Ответ: константа диссоциации азотной кислоты равна 5,6 ⋅ 10-3; рН раствора азотной кислоты 0,3.
4..Определить константу диссоциации и pH для 0,5 нормального раствора азотной кислоты (HNO3), если степень диссоциации равна 10 %.
|