Оксид серы (IV). Сернистая кислота и ее соли. Получение, структура молекул, тип гибридизации серы в сульфи-ионе и оксиде. Химические свойства SO2, H2SO3 и ее соли.Окси́д се́ры(IV) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой серни́стой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, се́рной кислоте. SO2 — один из основных компонентов вулканических газов. Сернистая кислота — неустойчивая слабая двухосновная неорганическая кислота средней силы. Отвечает степени окисления серы +4. Химическая формула Как двухосновная кислота она образует два ряда солей - сульфиты и гидросульфиты. Сульфиты образуются при полной нейтрализации кислоты щелочью: Н2SO3 + 2NаОН =NаHSО4+ 2Н2О Гидросульфиты получаются при недостатке щелочи (по сравнению с количеством, необходимым для полной нейтрализации кислоты): Н2SO3+NаОН = NаНSO3+ Н2О Получение 1) При сжигании серы в кислороде: S + O2 → SO2 2) Окислением сульфидов:4FeS2 + 11O2 → 2Fe2O3 + 8SO2 3) Обработкой солей сернистой кислоты минеральными кислотами: Na2SO3 + 2HCl → 2NaCl + SO2 + H2O 4) При окислении металлов концентрированной серной кислотой: Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2O
структура молекул, тип гибридизации серы в сульфи-ионе и оксиде(не нашла ответ) Химические свойства SO2: 1)Реакции, протекающие без изменения степени окисления, например: SO2+ Ca(OH)2= CaSO3¯+ H2O 2)Реакции, сопровождающиеся повышением степени окисления серы от 4+ до 6+, например: 2SO2+ O2= 2SO3 3)Реакции, протекающие с понижением степени окисления серы, например: SO2 + 2H2S = 3S + 2H2O Химические свойства H2SO3 и ее соли 1. может использоваться в качестве восстановителя или окислителя.H2SO3 является хорошим восстановителем. С ее помощью можно из свободных галогенов получить галогеноводороды. H2SO3+ Cl2+ H2O= H2SO4+ 2HCl Но при взаимодействии с сильными восстановителями данная кислота будет выполнять роль окислителя: H2SO3+2H2S=3S+3H2O 2. Рассматриваемое нами химическое соединение образует два вида солей - сульфиты (средние) и гидросульфиты (кислые). Эти соли являются восстановителями, так же, как и (H2SO3) сернистая кислота. При их окислении образуются соли серной кислоты. При прокаливании сульфитов активных металлов образуются сульфаты и сульфиды. Это реакция самоокисления-самовосстановления. Например:4Na2SO3= Na2S+ 3Na2SO4 Сульфиты натрия и калия (Na2SO3 и K2SO3) применяются при крашении тканей в текстильной промышленности, при отбеливании металлов, а также в фотографии. Кальция гидросульфит (Ca(HSO3)2), существующий только в растворе, используется для переработки древесного материала в специальную сульфитную целлюлозу. Из нее потом делают бумагу.
Оксид серы(6). Серная кислота и ее соли. Получение, структура молекул, характер связи.Отношение кислоты к металлам и неметаллам. Охрана окружающей среды от загрязнений оксидами серы. Окси́д се́ры (VI) - SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3. Се́рная кислота́; H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3: H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум). Соли серной кислоты Серная кислота диссоциирует ступенчато(H2SO4 H++HSO4-; HSO4- H++SO42-) поэтому она образует два вида солее – сульфаты и гидросульфаты. Например: Na2SO4- сульфат натрия (средняя соль),Na HSO4- гидросульфат натрия (кислая соль).Наибольшее применение находят: Na2SO4* 10H2O –глауберова соль (применяется при производстве соды, стекла, в медицине и ветеринарии. СaSO4*2H2O –гипс. СuSO4*5H2O –медный купорос(применяется в сельском хозяйстве).
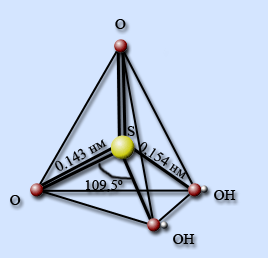
Получение серной кислоты: Получают серную кислоту в три стадии: 1стадия. В качестве сырья применяют серу, железный колчедан или сероводород: 4 FeS2+ 11 O2 = 2Fe2O3 + 8SO2. 2стадия. Окисление SO2 до SO3 кислородом при помощи катализатора V2O5: 2SO2 +O2 =2SO3 (+катализатор V2O5) +Q. 3стадия. Для превращения SO3 в серную кислот применяют не воду т.к. происходит сильное разогревание, а концентрированный раствор серной кислоты: SO3 +H2O =H2SO4. В результате получают олеум – раствор SO3 в серной кислоте. Строение молекулы серной кислоты: Неразбавленная серная кислота представляет собой ковалентное соединение.В молекуле серная кислота тетраэдрически окружена четырьмя атомами кислорода, два из которых входят в состав гидроксильных групп. Связи S – O – двойные, а S – OH – одинарные.
Бесцветные, похожие на лед кристаллы имеют слоистую структуру: каждая молекула H2SO4 соединена с четырьмя соседними прочными водородными связями, образуя единый пространственный каркас. Структура жидкой серной кислоты похожа на структуру твердой, только целостность пространственного каркаса нарушена. Концентрированная серная кислота очень активно взаимодействует с неметаллами. Реакцию растворения углерода в горячей концентрированной серной кислоте можно представить уравнением: С + 2 Н2SO4 = СО2 + 2 SO2 + 2 Н2О При окислении серы горячей концентрированной серной кислотой в качестве продукта окисления и продукта восстановления образуется диоксид серы: S + 2 Н2SO4 = 3 SO2 + 2 Н2О Концентрированная серная кислота окисляет бромид — и иодид-ионы до свободных брома и иода: 2 КВг + 2 Н2SO4 = К2SО4 + SO2 + Вr2 + 2Н2О; 2 КI + 2 Н2SО4 = К2SO4 + SO2 + 2 Н2О. Концентрированная серная кислота реагируют и с некоторыми малоактивными металлами, стоящими до водорода(Li, K, Ca, Na, Ba, Mg, Al, Zn, Fe, Ni, Sn, Pb ): Zn+ H2SO4 =ZnSO4+H2.
Охрана окружающей среды от загрязнений оксидами серы. В отходящих газах сернокислотных систем, работающих при атмосферном давлении и с однократным контактированием, содержится около 0,2% оксида серы (IV), около 0,007% оксида серы (VI) и брызги серной кислоты. Для очистки от оксида серы (IV) газ пропускают через башню, орошаемую раствором бисульфита аммония, а для улавливания оксида серы (VI) — через электрофильтр. Применяют и другие методы, например, добавляют к газам озон, который ускоряет окисление оксида серы (IV). При двойном контактировании с промежуточным удалением из газовой смеси оксида серы (VI) степень окисления оксида серы (IV) достигает 99,7%, и содержание его в отходящих газах уменьшается почти в 10 раз по сравнению с содержанием в отходящих газах после однократного контактирования.
|

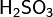 .
.