Количество теплоты. Теплоемкость газов. Уравнение Майера
Для характеристики тепловых процессов и тепловых свойств тел вводят понятия количества теплоты и теплоемкости. Энергия, переданная газу путем теплообмена (т.е. без совершения над ним работы) называется количеством теплоты Q. При сообщении системе количества теплоты δQ его температура изменяется на dT. Теплоемкость системы – это физическая величина, численно равная количеству теплоты, которое необходимо передать системе для того, чтобы изменить ее температуру на один градус. Теплоемкость в таком определении зависит от массы системы. Поэтому вводят понятия: удельная теплоемкость – это теплоемкость единицы массы (обозначают малой буквой с); молярная теплоемкость – это теплоемкость массы одного кмоля вещества, обозначают С. Молярная и удельная теплоемкости связаны соотношением С = с ∙ М. Теплоемкость зависит от характера процесса, т.е. от того, как мы производим передачу тепла данной системе. Из школьного курса известно, что количество теплоты ΔQ, необходимое для нагревания тела массой m от температуры T1 до температуры T2 равно ΔQ = m∙c∙ΔT (ΔT = T2 - T1). Запишем это выражение в дифференциальной форме dQ=m∙c∙dT. Отсюда выразим удельную теплоемкость
Для молярной теплоемкости, когда m =М, получим Если нагревание происходит при постоянном объеме, то вся теплота расходуется на изменение внутренней энергии (работа по расширению газа равна 0, т.к. dV = 0) dQ= dU и для 1кмоля газа получим выражение молярной теплоемкости при постоянном объеме
Если нагревание происходит при постоянном давлении (P = const), то подводимая теплота dQ расходуется на изменение внутренней энергии и совершение работы расширения газа РdV. Тогда теплоемкость при постоянном давлении для 1 кмоля будет иметь вид
Из уравнения Менделеева-Клапейрона
Нетрудно видеть, что CP = CV +R - это выражение носит название уравнения Майера. Из выражений CP и CV нетрудно получить их отношение γ
которое представляет собой показатель степени в уравнении Пуассона для адиабатного процесса. γ = 5/3 = 1,67- для одноатомных молекул идеального газа; γ = 7/5 = 1,4 – для двухатомных молекул идеального газа; γ = 8/6 = 1,33 – для трехатомных и многоатомных молекул идеального газа. Из уравнения Майера нетрудно уяснить физический смысл R. Молярная газовая постоянная численно равна работе, которую совершает 1 кмоль идеального газа при повышении его температуры на 1 К при постоянном давлении. Сравнение теоретических значений и экспериментальных данных CV, CP, γ, полученных при комнатных температурах, показывает их хорошее согласие. Согласно теории, теплоемкость не должна зависеть от температуры. Однако полученная экспериментальная зависимость CV от T для водорода (рис. 59) показывает, что это оказывается справедливым только в пределах отдельных температурных интервалов. Так на участке 1-1/
Это означает, что молекула ведет себя как система, обладающая только поступательными степенями свободы. На участке 2-2/, где Таким образом, число степеней свободы молекулы, проявляющееся в теплоемкости, зависит от температуры. При низких температурах наблюдается только поступательное движение молекул. При более высоких температурах наряду с поступательным движением наблюдается вращение молекул. И, наконец, при еще более высоких температурах к первым двум видам движения добавляются также колебания молекул. Монотонный ход кривой теплоемкости в промежуточных температурных интервалах говорит о том, что во вращательное, а затем и колебательное движение вовлекаются не сразу все молекулы. Объяснение такого поведения теплоемкости дается квантовой механикой. Энергия вращательного и колебательного движения оказывается квантованной. Это означает, что энергия, связанная с этими видами движения, может изменяться только скачками. Для энергии поступательного движения такого ограничения не существует.
|




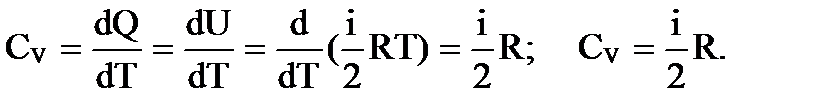
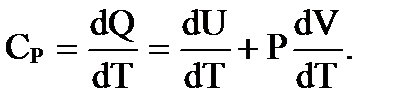
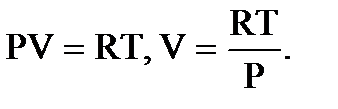 Подставляя V, получим
Подставляя V, получим
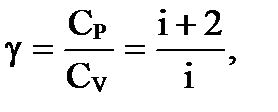

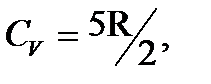 у молекулы добавляются еще две вращательные степени свободы. На участке 3-3/ при достаточно больших температурах CV делается равной
у молекулы добавляются еще две вращательные степени свободы. На участке 3-3/ при достаточно больших температурах CV делается равной 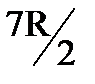 . Это свидетельствует о том, что при этих температурах атомы в молекулах совершают колебательное движение.
. Это свидетельствует о том, что при этих температурах атомы в молекулах совершают колебательное движение.


