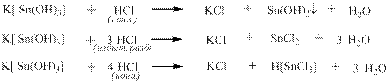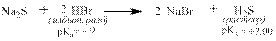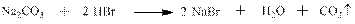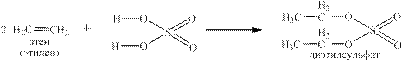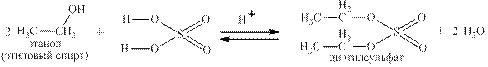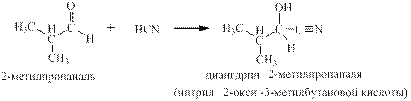Химические свойства кислот. Кислоты охотно реагируют со щелочами, вступая с ними в реакцию нейтрализацииКислоты охотно реагируют со щелочами, вступая с ними в реакцию нейтрализации. Например, KOH + HCl → KCl + H2O + 57 кДж/моль NaOH + NHO3 → NaNO3 + H2O + 57 кДж/моль LiOH + HClO4 → LiClO4 + H2O + 57 кДж/моль 2 KOH + H2SO4 → K2SO4 + 2 H2O + 114 кДж/моль Как видно из представленных данных все реакции, краткий ионный вид которых сводится к уравнению: Н+ + ОН− → Н2О имеют одинаковый тепловой эффект. Если же реакция осложнена выпадением осадка, то к тепловому эффекту нейтрализации добавляется тепловой эффект кристаллизации,например: Ba(OH)2 + H2SO4 → BaSO4↓ + 2 H2O + Q Q › 114 кДж/моль При нейтрализации слабых кислот выделение тепла заметно меньше, например:
Кислоты реагируют также с нерастворимыми в воде основаниями: 3 HNO3 + La(OH)3 → La(NO)3 + 3 H2O и амфотерными гидроксидами: Mg(OH)2 + 2 HBr → MgBr2 + 2 H2O Fe(OH)3 + 3 HNO3 → Fe(NO3)3 + 3 H2O Кислоты реагируют с основными оксидами: 2 H3PO4 + 3 CaO → Ca3(PO4)2 + 3 H2O с амфотерными: 6 HBr + Al2O3 → 2 AlBr3 + 3 H2O Некоторые кислоты могут реагировать и с кислотными оксидами: H2SO4 + SO3 → H2S2O7 8 H3PO4 + P4O10 → 6 H4P2O7 Обычные кислоты реагируют с металлами, стоящими в ряду напряжений левее водорода. Следует брать в качестве примеров металлы до магния включительно, так как они не реагируют с водой и реакция становится однозначной: Zn + H2SO4 → ZnSO4 + H2↑ 2 Al + 6 HCl → 2 AlCl3 + 3 H2↑ Если же взять барий или натрий, то они будут реагировать не только с кислотой HCl, но и с водой, которой в водном растворе, например, соляной кислоты всегда больше, чем самой кислоты. Ba + 2 H2O → Ba(OH)2 + H2↑ Ba + 2 HCl → BaCl2 + H2↑ Ba(OH)2 + 2 HCl → BaCl2 + 2 H2O↑ Кислоты – окислители такие, например, как концентрированная серная кислота или азотная кислота любых концентраций реагируют и с металлами, стоящими в ряду напряжений справа от водорода:
2 Bi + 6 H2SO4 40% → Bi2(SO4)3 + 3 SO2↑ + 6 H2O 3 Cu + 8 HNO3 разб. → 3 Cu(NO3)2 + 2 NO↑ + 4 H2O
Кислоты могут реагировать с гидроксил- и аммиаксодержащими комплексами, причём в зависимости от соотношения реагентов получаются различные конечные продукты:
Кислоты могут реагировать с солями более слабых, чем они кислот:
И с солями нестойких при нормальных условиях и, тем более, при комнатной температуре кислот:
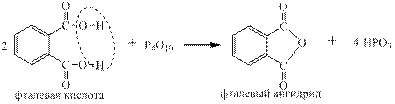
Ряд неорганических и все карбоновые кислоты вступают в реакции обмена с Р4О10:
Реакции азотной и хлорной кислот с Р4О10 были приведены на стр.8 Многие неорганические кислоты вступают в реакции с органическими веществами, например, серная с алкенами: и со спиртами:
азотная с глицерином:
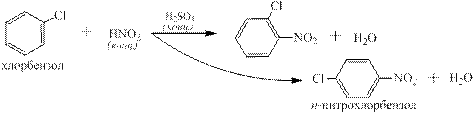
и ароматическими соединениями:
синильная с альдегидами:
|