Классификация сераорганических соединений в нефтиПриродные газы и нефти различных месторождений могут содержать сернистые соединения в количествах, колеблющихся в широких пределах – от нуля до десятков процентов. Известны нефти, в которых массовая доля серы превышает 10%. Например, нефть некоторых месторождений Западной Сибири, содержит даже до 14% серы, превышая при этом суммарную концентрацию всех остальных гетероатомов. Из многих тысяч нефтяных месторождений мира, которые в настоящее время разрабатываются, нет двух нефтей, содержащих одинаковое количество сернистых соединений с совпадающими химическими характеристиками. В связи с многообразием возможных сочетаний природных факторов, потенциально способных оказывать влияние на состав нефти, важнейшие характеристики распределения серы в нефтях, объединяющиеся по геолого-геохимическим признакам в одну и ту же группу, колеблются в сравнительно широких пределах. Тем не менее при рассмотрении достаточно большого объема данных удается выявить общую картину взаимосвязей и в определенной степени вскрыть характер влияния каждого геохимического параметра в отдельности. Значительно более ограничены колебания среднего содержания серы в нефтях, если они группируются по стратиграфическим, гипсометрическим и литологическим признакам. Специалисты по химии нефти давно подметили, что нефти, залегающие в карбонатных отложениях, в среднем содержат значительно больше серы, чем нефти из терригенных коллекторов. В терригенных отложениях над- и подсолевых толщ распространены преимущественно малосернистые нефти. Максимальное количество серы присутствуют в нефтях, погруженных на глубины 1500 – 2000м, соответствующие началу главной фазы нефтеобразования. На меньших глубинах залегают малосернистые нефти. С глубиной погружения температура и давление увеличиваются, катагенные процессы, развивающиеся на больших глубинах, протекают интенсивнее, и нефть постепенно обессеривается. Деструкция сернистых соединений, очевидно, сопровождается выделением сероводорода. Доказательство этого –повышение содержания сероводорода в природных газах с ростом глубины залегания, особенно в мезозойских и позднепалеозойских породах. В самых древних отложениях, вероятнее всего, залегают нефти с наименьшим содержанием серы, хотя возможны некоторые исключения.Многие исследователи установили, что содержание сернистых соединений во фракциях нефтей непрерывно нарастает с увеличением температуры выкипания фракций. В дистиллятах нефтей может содержаться до 70% сернистых соединений. Остальная часть сернистых соединений заключена в смолистоасфальтовой части нефти. Разумеется, такое распределение выдерживается не всегда, и некоторых нефтях большая часть сернистых соединений концентрируется в тяжелой смолистоасфальтовой части нефти.Состав сернистых соединений не менее сложен, чем углеводородный состав нефти и нефтяных дистиллятов, в растворах которых они находятся. В нефтях обнаружены меркаптаны, сульфиды, дисульфиды и тиофены. Каждое из этих соединений может быть представлено десятком различных индивидуальных веществ. В газах сера находится, главным образом, в составе сероводорода и низкомолекулярных меркаптанов (метил-, этил- меркаптаны), тогда как в нефтях она встречается как в минеральных веществах, так и в сераорганических соединениях, принадлежащих к различным классам. Наиболее типичные серосодержащие соединения, обнаруженные в нефтях, приведены ниже. 1) Меркаптаны или тиолы - это серосодержащие аналоги спиртов и фенолов, органические соединения, имеющие в своем составе функциональную группу -SH, называемой тиольной или меркаптановой. Общая формула их RSH. С4Н9SН – бутантиол 2) Сульфиды – это серосодержащие аналоги простых эфиров. Общая формула их - RSR'. С4Н9-S-С2Н5 – бутилэтилсульфид 3) Дисульфиды - это серосодержащие аналоги органических пероксидов. Общая формула их - RSSR. CH2=CHCH2 S – S CH2CH2CH3 Аллилпропилдисульфид. 4) Тиофены - это серосодержащие ароматические гетероциклы, включающие в качестве гетероатома серу. 5) Сульфоксиды R2S=O. CH3(C2H5)S=O метилэтилсульфоксид. 6) Сульфоновые кислоты R–SO2–OH. СН3–SO2–OH – метансульфоновая кислота. 7) сульфоны R–SO2–R. СН3–SO2–C2H5 – метилэтилсульфон.
В зависимости от группового состава сероорганические соединения можно условно разделить на три типа: 1 тип – меркаптановые, в которых в соизмеримы с сульфидами, дисульфидами и тиофенами количестве присутствуют меркаптаны; в таких нефтях возможно присутствие также сероводорода, дисульфидов и элементарной серы;
2 тип – характерен сульфидными соединениями, в которых преобладают сульфиды, в соизмеримом с ними или меньшем количестве имеются тиофены, а меркаптанов не более 5%;
3 тип – тиофеновые соединения, в которых содержатся преимущественно тиофены, сульфидов не более 10%, остальные сернистые соединения отсутствуют Наиболее распространены в природе сульфидные нефти, в которых обнаружены следующие сульфиды: - алифатические: R – S - R', где R и R' – предельные и непредельные алифатические радикалы; - ароматические: Ar – S – Ar, например, дифенилсульфид: С6Н5 – S - С6Н5; - жирно ароматические сульфиды: Alk – S – Ar, например, метилфенилсульфид: С6Н5 – СН2 - S - С6Н5; - циклические сульфиды, например, 2-метилтиациклогексан и 2- этилтиациклопентан; - сульфиды смешанного строения, содержащие различные углеводородные радикалы. Кроме меркаптанов, сульфидов и тиофенов в нефтях и нефтепродуктах можно обнаружить и полисульфиды. Это сернистые соединения с двумя, реже более чем с двумя, связанными между собой атомами серы. Наиболее распространены дисульфиды, в нефтяных фракциях их содержится приблизительно столько, сколько меркаптанов. Обычно дисульфиды присутствуют в фракциях, кипящих выше 1100С. С ростом температуры отгона их концентрация быстро падает и в дистиллятах, кипящих выше 3000С, становится почти неощутимой. По мере возрастания температуры кипения дистиллятов количество полифункциональных сернистых соединений увеличивается. Больше всего этих соединений этого типа в нефтяных остатках. Во фракциях, выкипающих до 1800С, значительную долю сернистых соединений составляют меркаптаны с тремя-четырьмя атомами углерода в молекуле, а во фракциях с температурами кипения 1800 - 3600С сернистые соединения представлены, в основном, циклическими и сероароматическими соединениями, имеющими в молекуле 8 – 11 углеродных атомов
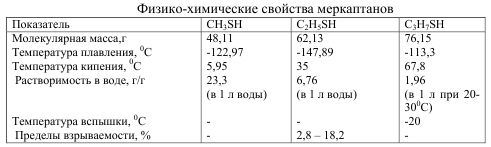
Основные физико-химические свойства серасодержащих органических соединений
Меркаптаны или их еще называют тиолы – обычные компоненты сернистых нефтей и газов. Основные физико-химические свойства легких меркаптанов видны из таблицы 1.
Алифатические меркаптаны получаются при взаимодействии сероводорода с олефинами или спиртами. Так, например метилмеркаптан получается взаимодействием метилового спирта с сероводородом в паровой фазе в присутствии Al2O3, промотированного K2WO4. Меркаптаны – слабые кислоты с резким специфическим запахом. Используют их в качестве одорантов бытового газа. Среди основных химических свойств можно отметить: 1) взаимодействие с щелочами или оксидами тяжелых металлов с образованием меркаптидов. Реакция благоприятно протекает особенно в присутствии СS2 в щелочной среде RSH + CS2 + NaOH → RSC(S)SNa + H2O 2) окисление меркаптанов приводит к образованию дисульфидов, которые далее окисляются до сульфокислот, так например, в отсутствии катализаторов при низкой температуре протекает реакция 2RSH + ЅО2 → RS – SR + H2O В присутствии щелочей скорость реакции повышается, особенно если окисление производится пероксидом +ОН- 2RSH + H2O2 → RS – SR + 2H2O Окисление меркаптанов можно проводить в присутствии кислорода воздуха, но при этом нельзя использовать КОН. В качестве катализаторов можно использовать алкиламины. В реакциях окисления меркаптанов кислородом катализаторами могут служить и ионы тяжелых металлов. Скорость реакции пропорциональна концентрации этих ионов. 3) при нагревании с сульфоксидами меркаптаны легко образуют дисульфиды 2RSH + R!2SO → SR + R!2S + H2O Если в качестве катализаторов использовать третичные амины, то это приведет к сильному увеличению выхода дисульфида. На скорость реакции каталитическое действие оказывают также уксусная, фосфорная и хлорная кислоты. 4) меркаптаны взаимодействуют с водородом с образованием сероводорода и соответствующего алкана RSH + Н2 → RH + Н2S Реакция протекает при повышенных температурах (200 – 300оС) и в присутствии катализаторов (никель- или кобальтмолибденовые). 5) при высоких температурах меркаптаны могут распадаться с образованием сероводорода или элементарной серы по реакциям
СnН2n+1SH ↔ СnН2n + Н2S 2СnН2n+1SH ↔ (СnН2n+1)2S + Н2S 2СnН2n+1SH ↔ 2СnН2n+2 + S2 Образование сероводорода с заметной скоростью протекает при температурах выше 2250С.
Сероуглерод – бесцветная жидкость с чрезвычайно неприятным запахом, хорошо растворяется во многих органических веществах – в спиртах, эфирах, хлороформе. Ни сероуглерод, ни его производные не содержатся в нефтях, но в незначительных количествах встречаются в некоторых природных газах. Особенно они образуются в больших количествах в процессе очистки газов и газов нефтепереработки от сероводорода по методу Клауса на высокотемпературной стадии. Из химических свойств сероуглерода следует отметить: 1) при нагревании легко взаимодействует с оксидами металлов, образуя соответствующие сульфиды CS2 + 2MgO → 2MgS + CO2 2) в процессе нагревания до высоких температур сероуглерод разлагается на серу и углерод лишь частично CS2 → С + S2 3) подвергается гидролизу CS2 + 2H2O → CO2 + 2Н2S 4) с серным ангидридом сероуглерод образует СОS – сероксид углерода CS2 + 3 SO3 = СОS + 4SO2 5) при высоких температурах сероуглерод может вступать во взаимодействие с водородом, образуя сероводород CS2 + 4H2 ↔ 2Н2S + СН4 Одним из важнейших производных сероуглерода является сероксид углерода СОS – при обычных условиях это бесцветный газ без запаха, растворяется в сероуглероде, спиртах и толуоле Основными химическими свойствами сероксида углерода являются: 1) при взаимодействии CS2 с кислородом образуются диоксиды серы и углерода CS2 + 3О2 ↔ CO2 + 2SO2 2) подвергается гидролизу СОS + H2O = CO2 + Н2S 3) при нагревании сероксид углерода разлагается 2СОS ↔ CO2+ CS2 2СОS ↔ 2CO+ 2S 4) легко взаимодействует с аммиаком, образуя карбонаты, которые во время длительного нагревания разлагаются с образованием сероводорода СОS + 2NH3 = CO(NH2)(SNH4) CO(NH2)(SNH4) = CO(NH2)2 + Н2S
Циклические соединения серы разделяются на 1) моноциклические (5-6 членные гетероциклы) 2) полициклические. К первой группе относятся семейства тиофана(С4Н8S) и тиофена(С4Н4S), ко второй группе семейства бензтиофана(С8Н8S) и бензтиофена(С8Н6S). Они представляют собой жидкости с характерным неприятным запахом, содержится в нефти, в продуктах переработки нефти.
тиофен
|