ДобуванняУ промисловості анілін отримують у дві стадії. На першій стадії бензол Нітрит сумішшю концентрованої азотної та сірчаної кислот при температурі 50 - 60 C в результаті утворюється нітробензол. На другому етапі нітробензол гидрируются при температурі 200-300 C у присутності каталізаторів
Вперше відновлення нітробензолу було вироблено з допомогою заліза:
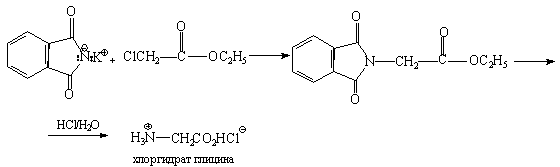
Іншим способом отримання аніліну є відновлення нітросполук - Реакція Зініна:
Виробництво і застосування Спочатку анілін отримували відновленням нітробензолу молекулярним воднем; практичний вихід аніліну не перевищував 15%. При взаємодії концентрованої соляної кислоти з залізом виділявся атомарний водень, більш хімічно активний у порівнянні з молекулярним. Реакція Зініна є більш ефективним методом отримання аніліну. У реакційну масу вливалинітробензол, який відновлюється до аніліну. Станом на 2002 рік, у світі основна частина виробленого аніліну використовується для виробництва метілдіізоціанатов, що використовуються потім для виробництва поліуретанів. Анілін також використовується при виробництві штучних каучуків,гербіцидів і барвників (фіолетового барвника мовеин). [1] У Росії він в основному застосовується в якості напівпродукту у виробництві барвників, вибухових речовин і лікарських засобів (сульфаніламідні препарати), але у зв'язку з очікуваним зростанням виробництва поліуретанів можливо значна зміна картини в середньостроковій перспективі. 46. Амінокислоти, склад,будова молекули, біполярний йон, фізичні властивості. Хімічні властивості амінокислот. Добування та застосування амінокислот. Значення амінокислот та білків у життєдіяльності організмів. Амінокислота — органічна сполука, молекули якої одночасно містять аміно- (-NH2) та карбоксильну (-СООН) групи. Амінокислоти є мономерними одиницями білків, у складі яких залишки амінокислот з'єднані пептидними зв'язками. Більшість білків побудовані із комбінації дев'ятнадцяти «первинних» амінокислот, тобто таких, що містять первинну аміногрупу, і однієї «вторинної» амінокислоти або імінокислоти (містить вторинну аміногрупу) проліну, що кодуютьсягенетичним кодом. Їх називають стандартними або протеїногенними амінокислотами. Крім стандартних в живих організмах зустрічаються інші амінокислоти, які можуть входити до складу білків або виконувати інші функції. Хімічна будова Усі амінокислоти містять карбоксильну й аміногрупи. В α-амінокислот вони приєднані до одного і того ж атома карбону. Решту молекули називають бічним ланцюгом або R-групою. Ці групи відрізняються за розміром, формою, гідрофільністю, електричним зарядом, схильністю формувати водневі зв'язки і загальною реакційною здатністю надаючи кожній амінокислоті унікальних властивостей. У найменшої амінокислоти — гліцину — бічного ланцюга немає, біля α-атома карбону крім каброксильної і аміногрупи розташовані два атоми водню. СПОСОБИ ОТРИМАННЯ АМІНОКИСЛОТ Застосування амінокислот Амінокислоти широко використовуються всучасної фармакології. Будучи не лише структурними елементами білків та інших ендогенних сполук, вони мають велике функціональне значення. Деякі з них виступають в якості нейромедіаторних речовин. Деякі амінокислоти знайшли самостійнезастосування в якості лікарських засобів. Амінокислоти застосовують також як парентерального харчування хворих, тобто минаючи шлунково-кишковий тракт, із захворюваннями травних і інших органів; а також для лікування захворювань печінки,недокрів'я, опіків (метіонін), виразок шлунка (гістидин), при нервово-психічних захворюваннях (глутамінова кислота і т. п.). Амінокислоти застосовуються в тваринництві та ветеринарії для харчування та лікування тварин, а також у мікробіологічної, медичної і харчової промисловості. Важливо приймати амінокислоти з кофакторами, якими зазвичай є вітаміни, мінеральні солі або інші поживні речовини, які допомагають амінокислотам в ході процесів метаболізму в організмі людини. Також важливо приймати амінокислоти у комплексі, а не просто якусь одну амінокислоту, оскільки в дію амінокислот залучені складні метаболічні шляхи, для яких необхідні різні кофактори та інші амінокислоти. Роль, значення і застосування амінокислот. Амінокислоти є основними складовими частинами та будівельними елементами білкової молекули. Молекула білка побудована з 100 або більше залишків амінокислот, ковалентно пов'язаних в полімерні ланцюги. У людському організмі 5 мільйонів білків, причому жоден з білків людини не ідентичний з білком будь-якого іншого живого організму. Незважаючи на таке розмаїття білкових структур для їх побудови необхідні всього 22 амінокислоти. Незамінні амінокислоти, їх всього 9, повинні надходити з їжею людини, вони не синтезуються в організмі людини, інші амінокислоти можуть утворюватися в нашому організмі з інших амінокислот. Біологічні функції білків дуже різноманітні. Вони виконують каталітичні, регуляторні, структурні, рухові, транспортні, захисні, запасні та інші функції. Білки становлять основу біомембран, найважливішої складової частини клітини і клітинних компонентів. Виключне властивість білка - самоорганізація структури, тобто здатність мимовільно створювати певну властиву тільки даному білку структуру. Для того, щоб організм міг ефективно використовувати і синтезувати білок, повинні бути присутніми всі незамінні амінокислоти і в необхідній пропорції. Навіть тимчасова відсутність однієї незамінної амінокислоти може негативно позначитися на синтезі білка. При зменшенні кількості будь незамінної амінокислоти або її відсутності пропорційно зменшується ефективність всіх інших. Багато факторів відіграють роль в появі дефіциту незамінних амінокислот, навіть при збалансованому харчуванні. Знижена абсорбція, стрес, інфекції, травми, хіміотерапія, вік та інші причини - все це може позначитися на дефіциті незамінних амінокислот в організмі. Крім 22 амінокислот, що входять до складу білків, відомо понад 150 інших, які зустрічаються в різних клітинах і тканинах або у вільному, або у зв'язаному вигляді, але ніколи не зустрічаються у складі білків. Значення амінокислот не обмежується їх роллю в синтезі тканинних білків. Кожна з них виконує в організмі свої особливі функції, спрямовані на підтримання гомеостазу організму. Корпорація «Vita Line» має цілим набором продуктів, які з окремих амінокислот, спрямованих на профілактику захворювань і лікування різних недуг. 47. Білки, склад молекули, структурна хімічна будова, поліпептидний зв'язок. Хімічні властивості: кольорові реакції на білок, денатурація білків. Значення амінокислот та білків у життєдіяльності організмів. Білки́ — складні високомолекулярні природні органічні речовини, що складаються з амінокислот, сполученихпептидними зв'язками. В однині (білок) термін найчастіше використовують для посилання на білок як речовину, коли неважливий її конкретний склад, та на окремі молекули або типи білків, у множині (білки) — для посилання на певну кількість білків, коли точний склад важливий. Хімічні властивості Білки також характеризуються ізоелектричною точкою (pI) — кислотністю середовища pH, при якому молекула даного білка не несе електричного заряду. Чим більше в даному білку гідроксильних груп (основних залишків), тим вище за нього pI. Білки з pI меншим за 7 називаються кислотними, а білки з pI більшим за 7 — основними. В цілому, pI білка залежить від функції, яку він виконує, так білки, що зв'язуються з нуклеїновими кислотами часто відносяться до основних білків. Прикладом таких білків служать гістони. За ступенем розчинності у воді білки бувають розчинними (гідрофільними) і нерозчинними (гідрофобними). До останніх відносяться більшість білків, що входять до складу біологічних мембран, тобто інтегральних мембранних білків, які взаємодіють з гідрофобними ліпідами мембрани.
Виділяють чотири рівні структури білків: · Первинна структура — пептидна або амінокислотна послідовність, тобто послідовність амінокислотних залишків упептидному ланцюжку. Саме первинна структура кодується відповідним геном і найбільшою мірою визначає властивості сформованого білка. · Вторинна структура — локальне впорядковування фрагменту поліпептидного ланцюжка, стабілізоване водневими зв'язками і гідрофобними взаємодіями. Найпоширеніші типи вторинної структури білків включають[9]: α-спіралі(спіраль, що має 4 залишки на виток, стабілізована водневими зв'язками між пептидними групами з кроком у 4 ланки) і β-листи (кілька зигзагоподібних поліпептидних низок, в яких водневі зв'язки утворюються між відносно віддаленими ділянками ланцюжка або між різними ланцюжками, а не між близько розташованими пептидними групами, як це має місце для α-спіралі). Інші елементи вторинної структури включають π-спіралі (спіралі з кроком водневих зв'язків у 3 ланки), · Третинна структура — повна просторова будова цілої білкової молекули, просторове взаємовідношення вторинних структур одна до одної. Третинна структура загалом стабілізується нелокальними взаємодіями, найчастіше формуванням гідрофобного ядра, а також завдяки утворенню водневих зв'язків,солевих містків, інших типів іонних взаємодій, дисульфідних зв'язків між залишкамицистеїну.До третинної структури зазвичай відносять і проміжні рівні між основними елементами вторинної структури та повною структурою білка — «надвторинну» структуру, що складається із структурних мотивів та доменів. Структурні мотиви — невеликі усталені поєднання кількох елементів вторинної структури, що мають схожу структуру, важливу для виконання білком певних функцій. Схожі структурні мотиви зазвичай виконують схожі функції, завдяки чому за ними можна передбачити функцію невідомого білка. Хоча структурні мотиви можуть бути аналогічними, частіше за все вони зберігаються в процесі еволюції видів. Домени — дещо більші елементи структури білка, що характеризуються стабілізацією незалежною від решти поліпептидного ланцюжка, і що часто виконують окрему функцію. В процесі еволюції елементи надвторинної структури можуть передаватися між генами, надаючи їм нові функції, таким чином існує набагато менше різновидів цих елементів, ніж різних білків. Процес передачі доменів можна здійснити і штучними методами генної інженерії, створюючи химерні білки. · Четвертинна структура — структура, що виникає в результаті взаємодії кількох білкових молекул, які в даному контексті називають субодиницями. Повна структура кількох поєднаних субодиниць, що разом виконують спільну функцію, називається білковим комплексом. Застосування білків у промисловості
· В промисловості білки використовують як сировину для різних виробництв. Так, з шерсті і шовку з давніх часів виготовляють тканини. З рогу і панцера черепахи виробляють гудзики, гребінці та інші дрібні речі. Білки кісток, хрящів і обрізків шкіри при кип’ятінні з водою утворюють клей. · З шкіри роблять взуття, одяг тощо. Казеїн, добутий з молока, використовують для обробки тканини (надання їм блиску), для виготовлення замазок та клею. Значення білків в життєдіяльності організмів. Складні високомолекулярні природні органічі речовини, що складаються з амінокислот, сполучених пептидними зв'язками. В однині (білок) термін найчастіше використовується для посилання на білок, як речовину, коли не важливий її конкретний склад, та на окремі молекули або типи білків, у множині (білки) — для посилання на деяку кількість білків, коли точний склад важливий. Зазвичай білки є лінійними полімерами — поліпептидами, хоча інколи мають більш складну структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаються пептидами. Послідовність амінокислот у конкретному білку визначається відповідним геном і зашифрована генетичним кодом. Хоча генетичний код більшості організмів визначає лише 20 «стандартних» амінокислот, їх комбінування уможливлює створення великого різномаїття білків із різними властивостями. Крім того, амінокислоти у складі білка часто піддаються посттрансляційним модифікаціям, які можуть виникати і до того, як білок починає виконувати свою функцію, і під час його «роботи» в клітині. Для досягнення певної функції білки можуть діяти спільно, і часто зв'язуються, формуючи великі стабілізовані комплекси (наприклад, фотосинтетичний комплекс). Функції білків в клітині різноманітніші, ніж функції інших біополімерів — полісахаридів і нуклеїнових кислот. Так, білки-ферменти каталізують протікання біохімічних реакцій і грають важливу роль в обміні речовин. Деякі білки виконують структурну або механічну функцію, утворюючи цитоскелет, що є важливим засобом підтримки форми клітин. Також білки грають важливу роль в сигнальних системах клітин, клітинній адгезії, імунній відповіді і клітинному циклі. Білки — важлива частина харчування тварин і людини, оскільки ці організми не можуть синтезувати повний набір амінокислот і повинні отримувати частину з них із білковою їжею. У процесі травлення протелітичні ферменти руйнують спожиті білки, розкладаючи їх до рівня амінокислот, які використовуються при біосинтезі білків організму або піддаються подальшому розпаду для отримання енергії. Секвенування першого білка — інсуліну, тобто визначення його амінокислотної послідовності. Перші тривимірні структури білків гемоглобіну і міоглобіну були отримані за допомогою рентгеноструктурного аналізу. 48. Волокна, класифікація.способи добування волокон, застосування волокон. Волокно́ — гнучке та міцне фізичне тіло обмеженої довжини з малими поперечними розмірами, яке придатне для виготовлення пряжі та текстильних виробів. Хімі́чні воло́кна — волокна, які одержують з продуктів хімічної переробки природних полімерів (штучні волокна) або з синтетичних полімерів (синтетичні волокна). Виробництво (т.з. формування) хімічних волокон звичайно полягає в продавлюванні розчину або розплаву полімеру через отвори фільєри в середовище, яке викликає затвердіння тонких волокон, що утворилися. Таким середовищем при формуванні з розплавів служить холодне повітря, з розчинів — гаряче повітря («сухий» спосіб) або спеціальний розчин, т.з. осадна ванна («мокрий» спосіб). Випускаються у вигляді мононитки, штапельного волокна або пучка з безлічі тонких ниток, з'єднаних шляхом сукання. Стадії виробництва синтетичних волокон
Синтетичні волокна випускають у вигляді моноволокна, текстильного або технічних ниток і штапельного волокна. Міцність синтетичного волокна може досягати 1,2 Гн/м², високоеластична деформація становить від 2 до 1000%. Текстильні та фізико-хімічні показники набагато різноманітніші, ніж у штучних волокон. Виробництво синтетичних волокон розвивається швидше виробництва штучних волокон, що пояснюється доступністю вихідної сировини, швидким розвитком виробництва різноманітних полімерів і, особливо, різноманітністю властивостей і високою якістю. Швидкість формування хімічного волокна дуже велика — 3000 м/хв. Залежно від виду вихідної сировини та умов його формування можна отримувати волокна з самими різними, заздалегідь наміченими властивостями. Чим сильніше тягнути цівку в момент виходу її з фільєри, тим міцніше виходить волокно. Іноді хімічні волокна навіть перевершують по міцності сталевий дріт такої ж товщини. Хімічна промисловість виробляє такі штучні волокна:
У світовій практиці штучні волокна (віскозні, ацетатні, триацетатні) мають різні позначення на етикетках: zoyon, acrylique, zelltuch, rayonne.
|











 -спіралі (спіралі з кроком водневих зв'язків у 5 ланок), повороти, невпорядковані фрагменти та інші. Найпоширеніша єдина класифікація таких структур — номенклатура DSSP.
-спіралі (спіралі з кроком водневих зв'язків у 5 ланок), повороти, невпорядковані фрагменти та інші. Найпоширеніша єдина класифікація таких структур — номенклатура DSSP.


