1. Во время работы в лаборатории соблюдайте тишину, не делайте лишних и резких движений, выполняйте опыты в отведенном месте.
2. Перед началом работы внимательно ознакомьтесь с техникой ее выполнения.
3. Используйте средства защиты: халат, резиновые перчатки, защитные очки, особенно при работе с кислотами и щелочами.
4. Проводите опыты, только предусмотренные преподавателем, соблюдая правила безопасности.
5. Будьте особенно осторожны в обращении с концентрированными растворами кислот, щелочей, огнеопасными и ядовитыми веществами.
6. В химической лаборатории не ешьте, не пробуйте вещества на вкус, не пейте из лабораторной посуды, не наклоняйтесь над склянкой с реактивами.
7. Определяя вещество по запаху, не делайте глубокого вдоха. Осторожно направляйте к себе газ или пар рукой.
8. Наливайте или насыпайте реактивы только над столом. Пролитые или рассыпанные реактивы немедленно удалите по указанию преподавателя. Не оставляйте открытыми склянки с жидкостями и банки с сухими реактивами. Участки кожи или одежды, на которые попал реактив, сначала тщательно смойте водой, затем протрите нейтрализующим веществом.
9. Для опыта берите вещество в количествах, указанных в руководстве или преподавателем. Оставшиеся вещества не сливайте и не ссыпайте в сосуд, из которого они были взяты, а собирайте только в специально предназначенную для этого посуду.
10. Убирайте свое рабочее место, не оставляйте посуду с остатками веществ.
11. Правильно пользуйтесь нагревательными приборами и строго соблюдайте правила безопасности при нагревании:
- Зажигайте спиртовку спичкой или лучинкой, гасите спиртовку, накрывая пламя колпачком.
- Нельзя нагревать вещества в толстостенной посуде.
- Отверстие открытого сосуда (пробирки) при нагревании в нем жидкости направляйте в сторону от себя и своих товарищей, не наклоняйтесь над нагреваемым сосудом.
- В пробирке нагревайте только небольшие количества вещества, жидкость должна занимать не более 1/3 объема пробирки.
- Пробирку с веществом сначала слегка прогрейте всю, затем нагревайте в нужном месте, не вынимая из пламени спиртовки. Нагревайте пробирку ниже уровня жидкости в ней.
- Поджигайте испытуемые газы и пары только после их проверки на чистоту.
- После нагревания немедленно погасите пламя.
12. Работы с вредными веществами можно проводить только под тягой. Концентрированные кислоты и щелочи наливать осторожно под вытяжным шкафом; не брать их на свои рабочие места.
13. Горячие приборы и посуду ставить только на специальные подставки, а не на открытый стол.
14. Нельзя пользоваться при проведении опытов грязной посудой.
15. Нельзя использовать стеклянную посуду, если на ней имеются трещины, сколы, щербины.
16. После окончания работы необходимо сразу же убрать реактивы и вымыть посуду.
Методическая разработка для студентов
к практическому занятию № 1
по дисциплине «Неорганическая химия»
тема: «Молекулярная масса и количество вещества»
Цели занятия:
Студент должен знать:
- теоретические основы аналитической химии
- методы качественного и количественного анализа
- качественные реакции, применяемые в фармацевтическом анализе
Студент должен уметь:
-периодического закона и характеристики элементов периодической системы Д.И. Менделеева;
- основы теории протекания химических процессов
-строения и реакционных способностей неорганических соединений
-способов получения неорганических соединений
-теории растворов и способов выражения концентрации растворов
Знания формул лекарственных средств неорганической природы
Оснащение: методические указания по выполнению работы с приложениями
Ориентировочная карта № 1 (задание на самоподготовку)
| № п/п
| Учебные элементы
| Истоки
| Цель деятельности
| Вопросы самоконтроля
|
|
| Задачи на нахождение количества вещества по ранее известной массе
| конспект лекции
| Знать основные формулы расчёта
| Дано:
m(Cu)=19,2г
____________________
Найти:
ν(Cu2O)=?
|
|
| Задачи по теме: «Относительная молярная масса»
| конспект лекции
| Уметь производить расчеты по химическим формулам
| Относительная молярная масса серной кислоты:
Мr(H2SO4) = 2Ar(H) + Ar(S) + 4Ar(O) = 2·1 + 32 + 4·16 = 98.
Определите: относительную молярную массу уксусной кислоты, соляной кислоты, азотной кислоты.
|
|
| Задания на знание химических терминов и законов
| конспект лекции
|
| 1. Отметьте правильные утверждения:
а) химический элемент обозначается химическим символом;
б) химические элементы имеют изотопы;
в) некоторые химические элементы получены искусственно;
г) в земной коре наиболее распространен элемент кислород.
2. Укажите формулы сложных веществ:
 3. При каких процессах протекают химические реакции:
а) фильтрование;
б) перегонка нефти;
в) гидратация этилена;
г) полимеризация этилена.
4. Укажите единицу измерения количества вещества:
а) г; б) кг; в) а.е.м.; г) моль.
5. Отметьте правильные утверждения. Относительная атомная масса:
а) показывает, во сколько раз масса атома больше 1/12 части массы изотопа углерода
3. При каких процессах протекают химические реакции:
а) фильтрование;
б) перегонка нефти;
в) гидратация этилена;
г) полимеризация этилена.
4. Укажите единицу измерения количества вещества:
а) г; б) кг; в) а.е.м.; г) моль.
5. Отметьте правильные утверждения. Относительная атомная масса:
а) показывает, во сколько раз масса атома больше 1/12 части массы изотопа углерода  б) имеет размерность г/моль;
в) безразмерная величина;
г) приведена в Периодической системе элементов.
6. Укажите массу атома углерода:
а) 12 г; б) 6 г; в)
б) имеет размерность г/моль;
в) безразмерная величина;
г) приведена в Периодической системе элементов.
6. Укажите массу атома углерода:
а) 12 г; б) 6 г; в)  7. Отметьте правильные утверждения. Постоянная Авогадро:
а) показывает число структурных единиц в 1г вещества;
б) показывает число структурных единиц в 1 моле вещества;
в) имеет размерность
7. Отметьте правильные утверждения. Постоянная Авогадро:
а) показывает число структурных единиц в 1г вещества;
б) показывает число структурных единиц в 1 моле вещества;
в) имеет размерность  г) равна 22,4 л.
8. Укажите массы или объемы соединений, в которых содержится 1 моль вещества:
а) 22,4 л
г) равна 22,4 л.
8. Укажите массы или объемы соединений, в которых содержится 1 моль вещества:
а) 22,4 л  б) 98 г
б) 98 г  в) 40 г NaOH;
г) 26 г
в) 40 г NaOH;
г) 26 г 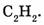 9. Укажите формулы аллотропных модификаций элемента кислорода:
а) О2;
б) О3; в)
9. Укажите формулы аллотропных модификаций элемента кислорода:
а) О2;
б) О3; в)  г) N0.
10. Укажите молекулу, которая имеет наибольшую массу:
а)
г) N0.
10. Укажите молекулу, которая имеет наибольшую массу:
а)  б) СО; б) СО;

 Относительная атомная и молекулярные массы. Типовые задачи и решения.
1-53. Пользуясь периодической системой химических элементов Д. И. Менделеева, укажите относительные атомные массы алюминия, хлора, натрия, кислорода, азота.
Решение.
Аг(Аl) = 27,
Аг(Сl) = 35,5,
Ar(Na) = 23,
Ar(O) = 16,
Ar(N) =14.
Относительная атомная и молекулярные массы. Типовые задачи и решения.
1-53. Пользуясь периодической системой химических элементов Д. И. Менделеева, укажите относительные атомные массы алюминия, хлора, натрия, кислорода, азота.
Решение.
Аг(Аl) = 27,
Аг(Сl) = 35,5,
Ar(Na) = 23,
Ar(O) = 16,
Ar(N) =14.
|
|
| нахождение отношения масс элементов по химической формуле в сложном веществе
| конспект лекции
| Знать методики определения веществ
| Вычислите массовое отношение химических элементов в гидроксиде кальция.
Решение,
1. Находим относительную молекулярную массу гидроксида кальция:
 2. Находим отношение масс атомов кальция, кислорода, водорода:
Са: О: Н = 40: 32: 2 = 20: 16: 1.
Ответ. Отношение масс кальция, кислорода и водорода равно 20: 16: 1.
1-58. Вычислите массовое отношение химических элементов в карбонате кальция.
Решение.
1. Находим относительную молекулярную массу карбоната кальция:
2. Находим отношение масс атомов кальция, кислорода, водорода:
Са: О: Н = 40: 32: 2 = 20: 16: 1.
Ответ. Отношение масс кальция, кислорода и водорода равно 20: 16: 1.
1-58. Вычислите массовое отношение химических элементов в карбонате кальция.
Решение.
1. Находим относительную молекулярную массу карбоната кальция:
 2. Находим отношение масс атомов кальция, углерода и кислорода:
Са: С: О = 40: 12: 48 = 10: 3: 12.
Ответ. Отношение масс кальция, углерода и кислорода равно 10: 3: 12.
Нахождение содержания массовых долей элементов в сложном веществе. Типовые задачи и решения.
1-59. Вычислите массовые доли элементов в молекуле серной кислоты.
Решение.
1. Находим относительную молекулярную массу серной кислоты:
2. Находим отношение масс атомов кальция, углерода и кислорода:
Са: С: О = 40: 12: 48 = 10: 3: 12.
Ответ. Отношение масс кальция, углерода и кислорода равно 10: 3: 12.
Нахождение содержания массовых долей элементов в сложном веществе. Типовые задачи и решения.
1-59. Вычислите массовые доли элементов в молекуле серной кислоты.
Решение.
1. Находим относительную молекулярную массу серной кислоты:
 2. Вычислим массовую долю водорода:
2. Вычислим массовую долю водорода:
 3. Вычислим массовую долю серы:
3. Вычислим массовую долю серы:
 4. Вычислим массовую долю кислорода:
4. Вычислим массовую долю кислорода:
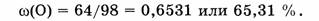 Примечание. Содержание кислорода можно также вычислить по разности:
Примечание. Содержание кислорода можно также вычислить по разности:
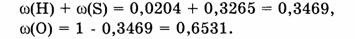 Ответ. Элементный состав
Ответ. Элементный состав  следующий:
массовая доля Н - 2,04%, массовая доля S - 32,65 % и массовая доля О - 65,31 %.
1-60. Вычислите массовые доли элементов в молекуле оксида железа (III).
Решение.
1. Находим относительную молекулярную массу оксида железа (III): следующий:
массовая доля Н - 2,04%, массовая доля S - 32,65 % и массовая доля О - 65,31 %.
1-60. Вычислите массовые доли элементов в молекуле оксида железа (III).
Решение.
1. Находим относительную молекулярную массу оксида железа (III):
 2. Вычислим массовую долю железа:
2. Вычислим массовую долю железа:
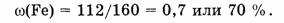 3) Вычислим массовую долю кислорода
3) Вычислим массовую долю кислорода
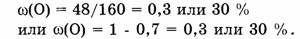 Ответ. Элементный состав
Ответ. Элементный состав  следующий:
массовая доля Fe - 70%, массовая доля О - 30%.
Содержание и определение основных понятий, используемых при количественных расчетах в школьном курсе химии
1. Количество вещества системы - размерная величина (физическая), характеризуемая численностью содержащихся в системе структурных частиц (атомов, молекул, ионов, электронов, протонов и др.). Обозначается следующий:
массовая доля Fe - 70%, массовая доля О - 30%.
Содержание и определение основных понятий, используемых при количественных расчетах в школьном курсе химии
1. Количество вещества системы - размерная величина (физическая), характеризуемая численностью содержащихся в системе структурных частиц (атомов, молекул, ионов, электронов, протонов и др.). Обозначается  (ню) или и (эн) и может быть определено по формуле (ню) или и (эн) и может быть определено по формуле  где N - число частиц в системе, где N - число частиц в системе,  - постоянная Авогадро - постоянная Авогадро  Единицей количества вещества является моль. Один моль равен количеству вещества, содержащего столько же структурных частиц данного вещества (элемента), сколько атомов содержится в углероде массой 0,012 кг
Единицей количества вещества является моль. Один моль равен количеству вещества, содержащего столько же структурных частиц данного вещества (элемента), сколько атомов содержится в углероде массой 0,012 кг  Пример.
Пример.  2. Молярная масса (М) - отношение массы вещества (m) к количеству вещества
2. Молярная масса (М) - отношение массы вещества (m) к количеству вещества  (кг/моль: г/моль).
Пример. М(Са) = 0,04 кг/моль или М(Са) = = 40 г/моль.
3. Молярный объем (кг/моль: г/моль).
Пример. М(Са) = 0,04 кг/моль или М(Са) = = 40 г/моль.
3. Молярный объем  - отношение объема вещества (V) к количеству - отношение объема вещества (V) к количеству   Пример.
Пример.  или 22,4 л/моль.
4. Массовая доля компонента в веществе (растворенного вещества в растворе, одного из компонентов в смеси, примесей в смеси). Массовой долей компонента в системе или 22,4 л/моль.
4. Массовая доля компонента в веществе (растворенного вещества в растворе, одного из компонентов в смеси, примесей в смеси). Массовой долей компонента в системе  называют безразмерную физическую величину, равную отношению массы компонента называют безразмерную физическую величину, равную отношению массы компонента  содержащегося в системе, к общей массе системы m.
5. Молярная доля компонента в системе содержащегося в системе, к общей массе системы m.
5. Молярная доля компонента в системе
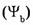 - безразмерная величина, равная отношению количества вещества компонента - безразмерная величина, равная отношению количества вещества компонента  к общему количеству вещества системы к общему количеству вещества системы 
 6. Молярная концентрация раствора
6. Молярная концентрация раствора  - отношение количества растворенного вещества - отношение количества растворенного вещества 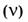 к объему раствора (V). к объему раствора (V).
 7. Объемная доля компонента в системе
7. Объемная доля компонента в системе  - безразмерная физическая величина, равная отношению приведенного объема компонента - безразмерная физическая величина, равная отношению приведенного объема компонента  к общему объему системы (V). к общему объему системы (V).
 При этом естественно возникает вопрос: сколько же атомов содержится в углероде массой 12 г (в 1 моль). Как же это определить? Надо массу всех атомов углерода (12 г) разделить на массу одного атома углерода, выраженную в граммах.
Дано:
При этом естественно возникает вопрос: сколько же атомов содержится в углероде массой 12 г (в 1 моль). Как же это определить? Надо массу всех атомов углерода (12 г) разделить на массу одного атома углерода, выраженную в граммах.
Дано:
 Найти. М(число атомов).
Решение:
Найти. М(число атомов).
Решение:  На основе решения данной задачи делают вывод: 1 моль любого вещества содержит 6*1023 частиц (атомов, молекул и др.). Это число называют по имени итальянского ученого Амедео Авогадро. Постоянную Авогадро обозначают
На основе решения данной задачи делают вывод: 1 моль любого вещества содержит 6*1023 частиц (атомов, молекул и др.). Это число называют по имени итальянского ученого Амедео Авогадро. Постоянную Авогадро обозначают  Далее можно вывести формулу для постоянной Авогадро.
Обозначим через
Далее можно вывести формулу для постоянной Авогадро.
Обозначим через  - постоянную Авогадро - число частиц в порции вещества, равной 1 моль. Тогда, как определить количество таких порций в системе - постоянную Авогадро - число частиц в порции вещества, равной 1 моль. Тогда, как определить количество таких порций в системе  Количество вещества системы равно отношению числа частиц системы и постоянной Авогадро. Отсюда выводятся две формулы:
Количество вещества системы равно отношению числа частиц системы и постоянной Авогадро. Отсюда выводятся две формулы:
 Из последней формулы следует, что постоянная Авогадро имеет размерность
Из последней формулы следует, что постоянная Авогадро имеет размерность
|
| дано:
m(Cu)=19,2г
____________________
Найти:
ν(Cu2O)=?
| |
| Вычислить молярные массы веществ, о которых, идёт речь в задаче
| М(Cu)=64г/моль М(Cu2O)=144г/моль
|
| Найдём количество вещества, масса которогодана в условии задачи
| ν(Сu) = m(Cu) / M(Cu) = 19.2 г / 64 (г /моль) = 0,3моль
|
| Запишем уравнение реакциии расставим коэффициенты
| 4 Cu + O2 = 2 Cu2O
|
| Над формулами веществ запишем
количества веществ из условия задачи,
а под формулами –
стехиометрические коэффициенты,
отображаемые уравнением реакции
|
0,3моль ν(Cu2O)=?моль
4 Cu + O2 = 2 Cu2O
4 моль 2 моль
|
| Для вычисления искомого количества вещества,составим соотношение
| По уравнению реакции:
ν(Сu) / ν(Cu2O) = 4 моль / 2 моль, отсюда
ν(Cu2O) = (ν(Сu) * 2 моль) / 4 моль =
= (0,3моль∙2 моль)/4 моль =
= 0,15 моль
|
| Запишем ответ
| Ответ: ν(Cu2O)=0,15 моль
|

 3. При каких процессах протекают химические реакции:
а) фильтрование;
б) перегонка нефти;
в) гидратация этилена;
г) полимеризация этилена.
4. Укажите единицу измерения количества вещества:
а) г; б) кг; в) а.е.м.; г) моль.
5. Отметьте правильные утверждения. Относительная атомная масса:
а) показывает, во сколько раз масса атома больше 1/12 части массы изотопа углерода
3. При каких процессах протекают химические реакции:
а) фильтрование;
б) перегонка нефти;
в) гидратация этилена;
г) полимеризация этилена.
4. Укажите единицу измерения количества вещества:
а) г; б) кг; в) а.е.м.; г) моль.
5. Отметьте правильные утверждения. Относительная атомная масса:
а) показывает, во сколько раз масса атома больше 1/12 части массы изотопа углерода  б) имеет размерность г/моль;
в) безразмерная величина;
г) приведена в Периодической системе элементов.
6. Укажите массу атома углерода:
а) 12 г; б) 6 г; в)
б) имеет размерность г/моль;
в) безразмерная величина;
г) приведена в Периодической системе элементов.
6. Укажите массу атома углерода:
а) 12 г; б) 6 г; в)  7. Отметьте правильные утверждения. Постоянная Авогадро:
а) показывает число структурных единиц в 1г вещества;
б) показывает число структурных единиц в 1 моле вещества;
в) имеет размерность
7. Отметьте правильные утверждения. Постоянная Авогадро:
а) показывает число структурных единиц в 1г вещества;
б) показывает число структурных единиц в 1 моле вещества;
в) имеет размерность  г) равна 22,4 л.
8. Укажите массы или объемы соединений, в которых содержится 1 моль вещества:
а) 22,4 л
г) равна 22,4 л.
8. Укажите массы или объемы соединений, в которых содержится 1 моль вещества:
а) 22,4 л  б) 98 г
б) 98 г  в) 40 г NaOH;
г) 26 г
в) 40 г NaOH;
г) 26 г 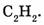 9. Укажите формулы аллотропных модификаций элемента кислорода:
а) О2;
б) О3; в)
9. Укажите формулы аллотропных модификаций элемента кислорода:
а) О2;
б) О3; в)  г) N0.
10. Укажите молекулу, которая имеет наибольшую массу:
а)
г) N0.
10. Укажите молекулу, которая имеет наибольшую массу:
а)  б) СО;
б) СО;

 Относительная атомная и молекулярные массы. Типовые задачи и решения.
1-53. Пользуясь периодической системой химических элементов Д. И. Менделеева, укажите относительные атомные массы алюминия, хлора, натрия, кислорода, азота.
Решение.
Аг(Аl) = 27,
Аг(Сl) = 35,5,
Ar(Na) = 23,
Ar(O) = 16,
Ar(N) =14.
Относительная атомная и молекулярные массы. Типовые задачи и решения.
1-53. Пользуясь периодической системой химических элементов Д. И. Менделеева, укажите относительные атомные массы алюминия, хлора, натрия, кислорода, азота.
Решение.
Аг(Аl) = 27,
Аг(Сl) = 35,5,
Ar(Na) = 23,
Ar(O) = 16,
Ar(N) =14.
 2. Находим отношение масс атомов кальция, кислорода, водорода:
Са: О: Н = 40: 32: 2 = 20: 16: 1.
Ответ. Отношение масс кальция, кислорода и водорода равно 20: 16: 1.
1-58. Вычислите массовое отношение химических элементов в карбонате кальция.
Решение.
1. Находим относительную молекулярную массу карбоната кальция:
2. Находим отношение масс атомов кальция, кислорода, водорода:
Са: О: Н = 40: 32: 2 = 20: 16: 1.
Ответ. Отношение масс кальция, кислорода и водорода равно 20: 16: 1.
1-58. Вычислите массовое отношение химических элементов в карбонате кальция.
Решение.
1. Находим относительную молекулярную массу карбоната кальция:
 2. Находим отношение масс атомов кальция, углерода и кислорода:
Са: С: О = 40: 12: 48 = 10: 3: 12.
Ответ. Отношение масс кальция, углерода и кислорода равно 10: 3: 12.
Нахождение содержания массовых долей элементов в сложном веществе. Типовые задачи и решения.
1-59. Вычислите массовые доли элементов в молекуле серной кислоты.
Решение.
1. Находим относительную молекулярную массу серной кислоты:
2. Находим отношение масс атомов кальция, углерода и кислорода:
Са: С: О = 40: 12: 48 = 10: 3: 12.
Ответ. Отношение масс кальция, углерода и кислорода равно 10: 3: 12.
Нахождение содержания массовых долей элементов в сложном веществе. Типовые задачи и решения.
1-59. Вычислите массовые доли элементов в молекуле серной кислоты.
Решение.
1. Находим относительную молекулярную массу серной кислоты:
 2. Вычислим массовую долю водорода:
2. Вычислим массовую долю водорода:
 3. Вычислим массовую долю серы:
3. Вычислим массовую долю серы:
 4. Вычислим массовую долю кислорода:
4. Вычислим массовую долю кислорода:
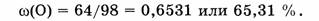 Примечание. Содержание кислорода можно также вычислить по разности:
Примечание. Содержание кислорода можно также вычислить по разности:
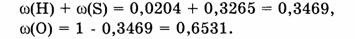 Ответ. Элементный состав
Ответ. Элементный состав  следующий:
массовая доля Н - 2,04%, массовая доля S - 32,65 % и массовая доля О - 65,31 %.
1-60. Вычислите массовые доли элементов в молекуле оксида железа (III).
Решение.
1. Находим относительную молекулярную массу оксида железа (III):
следующий:
массовая доля Н - 2,04%, массовая доля S - 32,65 % и массовая доля О - 65,31 %.
1-60. Вычислите массовые доли элементов в молекуле оксида железа (III).
Решение.
1. Находим относительную молекулярную массу оксида железа (III):
 2. Вычислим массовую долю железа:
2. Вычислим массовую долю железа:
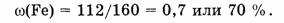 3) Вычислим массовую долю кислорода
3) Вычислим массовую долю кислорода
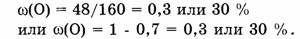 Ответ. Элементный состав
Ответ. Элементный состав  следующий:
массовая доля Fe - 70%, массовая доля О - 30%.
Содержание и определение основных понятий, используемых при количественных расчетах в школьном курсе химии
1. Количество вещества системы - размерная величина (физическая), характеризуемая численностью содержащихся в системе структурных частиц (атомов, молекул, ионов, электронов, протонов и др.). Обозначается
следующий:
массовая доля Fe - 70%, массовая доля О - 30%.
Содержание и определение основных понятий, используемых при количественных расчетах в школьном курсе химии
1. Количество вещества системы - размерная величина (физическая), характеризуемая численностью содержащихся в системе структурных частиц (атомов, молекул, ионов, электронов, протонов и др.). Обозначается  (ню) или и (эн) и может быть определено по формуле
(ню) или и (эн) и может быть определено по формуле  где N - число частиц в системе,
где N - число частиц в системе,  - постоянная Авогадро
- постоянная Авогадро  Единицей количества вещества является моль. Один моль равен количеству вещества, содержащего столько же структурных частиц данного вещества (элемента), сколько атомов содержится в углероде массой 0,012 кг
Единицей количества вещества является моль. Один моль равен количеству вещества, содержащего столько же структурных частиц данного вещества (элемента), сколько атомов содержится в углероде массой 0,012 кг  Пример.
Пример.  2. Молярная масса (М) - отношение массы вещества (m) к количеству вещества
2. Молярная масса (М) - отношение массы вещества (m) к количеству вещества  (кг/моль: г/моль).
Пример. М(Са) = 0,04 кг/моль или М(Са) = = 40 г/моль.
3. Молярный объем
(кг/моль: г/моль).
Пример. М(Са) = 0,04 кг/моль или М(Са) = = 40 г/моль.
3. Молярный объем  - отношение объема вещества (V) к количеству
- отношение объема вещества (V) к количеству 
 Пример.
Пример.  или 22,4 л/моль.
4. Массовая доля компонента в веществе (растворенного вещества в растворе, одного из компонентов в смеси, примесей в смеси). Массовой долей компонента в системе
или 22,4 л/моль.
4. Массовая доля компонента в веществе (растворенного вещества в растворе, одного из компонентов в смеси, примесей в смеси). Массовой долей компонента в системе  называют безразмерную физическую величину, равную отношению массы компонента
называют безразмерную физическую величину, равную отношению массы компонента  содержащегося в системе, к общей массе системы m.
5. Молярная доля компонента в системе
содержащегося в системе, к общей массе системы m.
5. Молярная доля компонента в системе
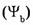 - безразмерная величина, равная отношению количества вещества компонента
- безразмерная величина, равная отношению количества вещества компонента  к общему количеству вещества системы
к общему количеству вещества системы 
 6. Молярная концентрация раствора
6. Молярная концентрация раствора  - отношение количества растворенного вещества
- отношение количества растворенного вещества 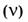 к объему раствора (V).
к объему раствора (V).
 7. Объемная доля компонента в системе
7. Объемная доля компонента в системе  - безразмерная физическая величина, равная отношению приведенного объема компонента
- безразмерная физическая величина, равная отношению приведенного объема компонента  к общему объему системы (V).
к общему объему системы (V).
 При этом естественно возникает вопрос: сколько же атомов содержится в углероде массой 12 г (в 1 моль). Как же это определить? Надо массу всех атомов углерода (12 г) разделить на массу одного атома углерода, выраженную в граммах.
Дано:
При этом естественно возникает вопрос: сколько же атомов содержится в углероде массой 12 г (в 1 моль). Как же это определить? Надо массу всех атомов углерода (12 г) разделить на массу одного атома углерода, выраженную в граммах.
Дано:
 Найти. М(число атомов).
Решение:
Найти. М(число атомов).
Решение:  На основе решения данной задачи делают вывод: 1 моль любого вещества содержит 6*1023 частиц (атомов, молекул и др.). Это число называют по имени итальянского ученого Амедео Авогадро. Постоянную Авогадро обозначают
На основе решения данной задачи делают вывод: 1 моль любого вещества содержит 6*1023 частиц (атомов, молекул и др.). Это число называют по имени итальянского ученого Амедео Авогадро. Постоянную Авогадро обозначают  Далее можно вывести формулу для постоянной Авогадро.
Обозначим через
Далее можно вывести формулу для постоянной Авогадро.
Обозначим через  - постоянную Авогадро - число частиц в порции вещества, равной 1 моль. Тогда, как определить количество таких порций в системе
- постоянную Авогадро - число частиц в порции вещества, равной 1 моль. Тогда, как определить количество таких порций в системе  Количество вещества системы равно отношению числа частиц системы и постоянной Авогадро. Отсюда выводятся две формулы:
Количество вещества системы равно отношению числа частиц системы и постоянной Авогадро. Отсюда выводятся две формулы:
 Из последней формулы следует, что постоянная Авогадро имеет размерность
Из последней формулы следует, что постоянная Авогадро имеет размерность



