Строение атома. Атом – наименьшая частица химического элемента – носитель всех его химических свойствАтом – наименьшая частица химического элемента – носитель всех его химических свойств. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. Ядро составляет основу атома и определяет индивидуальность элементов. В ядро атомов всех элементов (исключение При всех химических процессах ядра атомов элементов, входящих в состав реагирующих веществ, не изменяются. Изменение при этом претерпевают только электронные оболочки. Химическая энергия, таким обладающая элементарным отрицательным электрическим зарядом, равным 1,602*10-19 Кл. Масса покоя электрона мала и составляет 1/1837,14 массы протона. Как показала квантовая механика, электрон наряду со свойствами вещества (частица) обладает и свойствами электромагнитного поля. Таким образом, в свойствах электрона, в законах его движения проявляется неразрывность двух качественно различных форм существования материи: вещества и поля. Электрону, как любому микрообъекту, присуща двойственная корпускулярно-волновая природа. Движение электрона в атоме носит вероятностно – волновой характер. Околоядерное пространство, в котором с наибольшей вероятностью может находиться электрон, называется атомной орбиталью (АО). АО, как любая геометрических фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, ml). Они определяют размер (n), форму (l) и ориентацию (ml) атомной орбитали в пространстве. Занимая ту или иную АО, электрон образует электронное облако (электронную орбиталь). Формы электронных облаков аналогичны АО (рис.1). электронное облако характеризуется четырьмя квантовыми числами (n, l,ml, ms). Набором этих чисел можно полностью охарактеризовать состояние любого электрона в атоме. Главное квантовое число n определяет основную характеристику
электрона в атоме – его энергию и энергетический уровень. Она определяет также размеры АО. Для электронов, находящихся в невозбужденных атомах, n принимает значение от 1 до 7 (соответственно номеру периода в периодической системе элементов Д.М.Менделеева). совокупность электронов в атоме, обладающих одинаковым значением n, называют электронным слоем, эти слои обозначают: n 1 2 3 4 5 6 7 K L M N O P Q Орбитальное квантовое число l указывает на различие в энергии связи электронов, находящихся в пределах одного энергетического уровня. Электроны данного энергетического уровня группируются в подуровни. Орбитальное квантовое число определяет форму электронных орбиталей атома (рис. 1), l принимает целочисленные значения от 0 до n – 1. Для n=1 l=0; для n = 2 l = 0,1; для n = 3 l = 0,1,2; для n = 4 l = 0,1,2,3. Число подуровней в каждом энергетическом уровне равно его главному квантовому числу (табл.1). Больше четырех подуровней не заполняется, так как значение l = 0,1,2,3 описывают электроны в атомах всех известных элементов. АО, для которых l = 0, 1, 2, 3, соответственно называют s -, p -, d -, f -орбиталями, а электроны, занимающие эти орбитали, - соответственно s -, p -, d -, f - электронами. Магнитное квантовое число ml характеризует магнитный момент и пространственное расположение электронных облаков (рис.1). Число возможных значений магнитного квантового числа при заданном l равно 2l+1. l = 0, ml = 0 l = 1, ml = -1, 0, +1 l = 2 ml = -2, -1, 0, +1, +2 l = 3, ml =-3, -2, -1, 0, +1, +2, +3 Спиновое квантовое число ms характеризует движение электрона вокруг своей оси. Оно имеет +1/2 и -1/2. Энергетические состояния электрона схематически обозначают в виде квантовых (энергетических) ячеек, электроны в этих ячейках обозначают стрелками. Распределение электронов в атомах элементов по АО определяется принципом Паули, принципом наименьшей энергии и правилом Хунда. 1. Принцип Паули: в атоме не может быть двух и более электронов, имеющих одинаковый набор всех четырех квантовых чисел. Так как АО характеризуется тремя квантовыми числами: n, l, ml, то в ней могут находиться не более двух электронов с противоположными спинами. Согласно принципу Паули, максимальное число электронов на уровне N = 2n2 (табл 1). 2. Принцип наименьшей энергии. Правило Клечковского: последовательность размещения электронов по АО в невозбужденном атоме должна отвечать наибольшей связи их с ядром, т.е. электрон должен обладать наименьшей энергией. Согласно этому правилу электроны заполняют уровни и подуровни в такой последовательности (шкала энергий):
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 5f14 5d2-10 6p6 7s2 6d1 5f14 6d2-10 7p5,
где s, p, d, f – энергетические подуровни, цифры впереди букв означают энергетический уровень, в котором находятся данные электроны, а индекс наверху справа показывает число электронов на данном подуровне. Как следует из шкалы энергий, сначала заполняется 4s – подуровень, а затем 3d; 5s – подуровень, а затем 4d. Такая последовательность заполнения уровней и подуровней обусловлена принципом наименьшей энергии и правилом Клечковского: так как энергия электрона в основном определяется значениями главного квантового числа n и орбитального l, то сначала заполняются те подуровни, для которых сумма значений n +1 равны,то сначала идет заполнение подуровня с меньшим значением n. Отсюда следует, что после 3 p – подуровня заполняется 4 s – подуровень (n +l = 4 + 0=4), затем 3 d – подуровень (n + l = 3 +2 = 5), 4p (n +l=4+1=5) и 5 s -подуровень (n+l=5+0=5). Правило Хунда: орбитали в пределах данного подуровня заполняются сначала электрону, т.е каждый электрон располагается в отдельной квантовой ячейке в виде неспаренного электрона. Иными словами, при данном значении l электроны располагаются так, что суммарное спиновое число их (∑ms) максимально. Суммарный спин спаренных электронов равен нулю. Например, если три р-орбитали (px, py, pz) надо заполнить тремя p-электронами, то они должны распределяться по одному в каждой отдельной орбитали (ячейке). Схематически распределение электронов по квантовым ячейкам будет следующим: или
∑mss = + 1/2 +1/2 +1/2 = +3/2 или ∑mss = -1/2 – 1/2 – 1/2 = - 3/2 Строение электронных оболочек атомов тесно связано с периодической системой элементов Д.М.Менделеева. Номер периода равен количеству энергетических уровней (электронная оболочка атомов элементов 2-го периода имеет два энергетических уровня. 3-го периода – три, 4-го периода – четыре и т.д.). Всего 7 энергетических уровней и соответственно 7 периодов. Длина периодов определяется максимальной емкостью уровней: 2, 8, 18, 32 электрона. В 1-м периоде – 2 элемента; во 2-м и 3-м – 8 элементов; в 4-м и 5-м – 18 элементов; в 6-м – 32 элемента; 7 й период не закончен. В зависимости от того, на какой энергетический подуровень в атоме поступает последний электрон, элементы делятся на s-, p-, d- и f- элементы. При этом s - элементы составляют I и II главные подгруппы периодической системы (а также H и He); p -элементы составляют III, IV, V, VI, VII и VIII главные подгруппы периодической системы; d -элементы составляют побочные подгруппы периодической системы. У s - и p -элементов валентные электроны находятся на внешнем энергетическом уровне, у d - элементов – на s -подуровне внешнего энергетического уровня и предвнешнего незавешенного d-подуровня, f -элементы в коротко периодном варианте периодической таблицы выделены отдельно. На основании рассмотренных положений можно представить распределение электронов в атоме записывается в виде электронных формул. Чтобы составить электронную формулу атома любого элемента, следует знать номер данного элемента в периодической системе и перечисленные выше положения. Электронная формула фосфора будет составляться следующим образом: фосфор находится в 3-м периоде, порядковый номер 15, значит, 15электронов будут располагаться на трех энергетических уровнях (15Р 1s22s22p63s23p3).
Электронная структура атома может быть изображена в виде размещения электронов в квантовых ячейках (атомных орбиталях). Для атомов фосфора электронографическая схема выглядет так:
s n = 1 p n = 2 d n = 3
Пример. Сколько протонов и нейтронов содержат ядра изотопов ванадия Решение. Порядковый номер элемента в периодической системе совпадает с величиной заряда ядра, т.е индекс внизу слева символа элемента указывает на количество протонов в ядре, следовательно, в ядрах изотопов ванадия имеется 23 протона. Число нейтронов равняется разности между массовым числом (индекс вверху слева символа) и порядковым номером элемента, следовательно, в ядрах изотопа Электронные формулы отображают распределение электронов в атоме по энергетическим уровням и подуровням. При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котром он будет обладать наименьшей энергией. Так как число электронов в атоме элемента равно заряду ядра, т.е его порядковому номеру в таблице Д.И.Менделеева, то элемента №23 – ванадия электронная формула, согласно шкале энергий, будет 23V 1s22s22p63s23p6 4s23d3 23V 1s22s22p63s23p6 3p34s2 Электронографические схемы отражают распределение электронов атомов по квантовым (энергетическим) ячейкам. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами (принцип Паули). Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда).
s n = 1 p n =2
d n = 3 f n = 4 Последний, 23-й электрон атома ванадия занимает d – орбиталь, следовательно, ванадий относится к d- электронному семейству.
|

 ) входят протоны и нейтроны, которые могут взаимно превращаться друг друга. Протон (р) – элементарная частица с массой покоя 1,00728 и положительным зарядом, по абсолютной величине равным заряду электрона. Число протонов в ядре характеризует его заряд и принадлежность атома данному химическому элементу. Нейтрон (n) также представляет собой элементарную частицу, но не обладающую электрическим зарядом; масса покоя нейтрона составляет 1,00867. Сумма числа протонов и числа нейтронов, содержащихся в ядре атома, называется массовым числом атома (ядра). Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов (а значит, и разным массовым числом), называют изотопами. Как правило, каждый элемент представляет собой совокупность нескольких изотопов. Именно этим объясняются значительные отклонения атомных масс многих элементов от целочисленных величин.
) входят протоны и нейтроны, которые могут взаимно превращаться друг друга. Протон (р) – элементарная частица с массой покоя 1,00728 и положительным зарядом, по абсолютной величине равным заряду электрона. Число протонов в ядре характеризует его заряд и принадлежность атома данному химическому элементу. Нейтрон (n) также представляет собой элементарную частицу, но не обладающую электрическим зарядом; масса покоя нейтрона составляет 1,00867. Сумма числа протонов и числа нейтронов, содержащихся в ядре атома, называется массовым числом атома (ядра). Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов (а значит, и разным массовым числом), называют изотопами. Как правило, каждый элемент представляет собой совокупность нескольких изотопов. Именно этим объясняются значительные отклонения атомных масс многих элементов от целочисленных величин.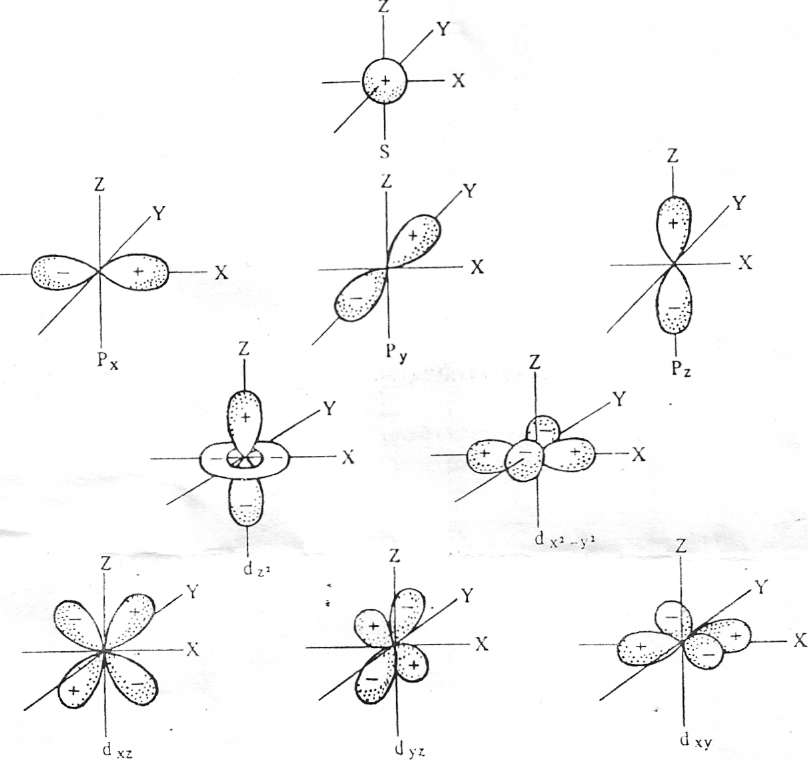 Рис. 1. Формы электронных облаков (орбиталей)
Рис. 1. Формы электронных облаков (орбиталей)
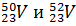 ? Составьте электронную формулу атома ванадия, подчеркните валентные электроны. Распределите электроны этого атома по квантовым ячейкам. К какому электронному семейству относится этот элемент?
? Составьте электронную формулу атома ванадия, подчеркните валентные электроны. Распределите электроны этого атома по квантовым ячейкам. К какому электронному семейству относится этот элемент?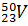 находится 27 нейтронов (50 – 23 = 27), а
находится 27 нейтронов (50 – 23 = 27), а 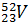 - 29 нейтронов (52 – 23 = 29).
- 29 нейтронов (52 – 23 = 29).


