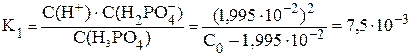Пример 6.4. Рассчитать массовую долю фосфорной кислоты, в растворе, pH которого равен 1,7. Плотность раствора принять равной 1 г/мл.
H3PO4 – слабая трёхосновная кислота, обратимо диссоциирующая в водном растворе (преимущественно по первой стадии): H3PO4 ⇆ H+ + H2PO4–.
C(H+) = 10–pH = 10–1,7 = 1,995·10–2 (моль/л)
Если бы продиссоциировало x моль/л фосфорной кислоты, тогда равновесная концентрация ионов водорода и дигидрофосфат-ионов была бы равна x моль/л: C(H2PO4–) = C(H+) = x моль/л. Концентрация непродиссоциировавшей кислоты в этом случае будет равна: С(H3PO4) = С0 – x моль/л.
В данном примере величина х известна:
x = C(H+) = C(H2PO4–) = 1,995·10–2 моль/л
H 3PO 4 ⇆ H + + H 2PO 4–
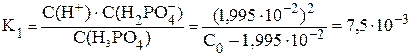
С0 = 0,073 (моль/л).
По определению молярной концентрации
в 1 л раствора содержится 0,073 моль H3PO4.
mраствора = Vраствора · ρраствора = 1000 мл · 1 г/мл = 1000 г.
m(H3PO4) = n(H3PO4) · M(H3PO4) = 0,073 моль · 98 г/моль = 7,157 г.
ω(H3PO4) = m(H3PO4) / mраствора = 7,157 г / 1000 г = 0,007157 (0,716 %)
Задание № 8
Таблица 6.1 – Условие задания № 8
| Вариант
| а) рассчитать pH
| б) рассчитать концентрацию
электролита в растворе
| |
| 0,03M Ca(OH)2
| 0,6% H2CO3
r = 1 г/мл
| pH = 13,5; r = 1 г/мл
w(Ba(OH)2) –?
| pH = 4,3
C(CH3COOH) –?
| |
| 0,05M H2SO4
| 0,2% H3PO4
r = 1 г/мл
| pH = 10,2; r = 1 г/мл
w(NaOH) –?
| pH = 11,1
C(NH4OH) –?
| |
| 0,02M Ba(OH)2
| 0,8% HF
r = 1 г/мл
| pH = 1,5; r = 1 г/мл
w(HCl) –?
| pH = 11,3
C(NH4OH) –?
| |
| 0,03M NaOH
| 0,1% NH4OH
r = 1 г/мл
| pH = 12,8; r = 1 г/мл
w(Ba(OH)2) –?
| pH = 3,9
C(H2S) –?
| |
| 0,05M HCl
| 0,9% H2SO3
r = 1 г/мл
| pH = 1,2; r = 1 г/мл
w(H2SO4) –?
| pH = 10,8
C(NH4OH) –?
| |
| 0,04M H2SO4
| 0,7% CH3COOH
r = 1 г/мл
| pH = 13,2; r = 1 г/мл
w(Ca(OH)2) –?
| pH = 1,8
C(H2SO3) –?
| |
| 0,05M Ca(OH)2
| 0,3% H2CO3
r = 1 г/мл
| pH = 12,5; r = 1 г/мл
w(Ba(OH)2) –?
| pH = 1,2
C(H3PO4) –?
| |
| 0,08M Ba(OH)2
| 0,8% NH4OH
r = 1 г/мл
| pH = 13,3; r = 1 г/мл
w(NaOH) –?
| pH = 3,8
C(H2S) –?
| |
| 1,05M H2SO4
| 0,1% H3PO4
r = 1 г/мл
| pH =12,2; r = 1 г/мл
w(Sr(OH)2) –?
| pH = 2,5
C(HF) –?
| |
| 0,09M NaOH
| 0,7% H2SO3
r = 1 г/мл
| pH = 0,8; r = 1 г/мл
w(HCl) –?
| pH = 11,2
C(NH4OH) –?
| |
| 0,08M HCl
| 0,2% H2S
r = 1 г/мл
| pH = 0,5; r = 1 г/мл
w(H2SO4) –?
| pH = 12,3
C(NH4OH) –?
| |
| 0,06M Ba(OH)2
| 0,5% HF
r = 1 г/мл
| pH = 12,5; r = 1 г/мл
w(Ca(OH)2) –?
| pH = 2,4
C(CH3COOH) –?
| |
| 0,02M H2SO4
| 0,4% CH3COOH
r = 1 г/мл
| pH = 13,3; r = 1 г/мл
w(NaOH) –?
| pH = 5,5
C(H2CO3) –?
| |
| 0,06M HCl
| 0,8% H2S
r = 1 г/мл
| pH = 1,2; r = 1 г/мл
w(H2SO4) –?
| pH = 10,8
C(NH4OH) –?
| |
| 0,05M NaOH
| 0,6% HF
r = 1 г/мл
| pH = 0,5; r = 1 г/мл
w(HNO3) –?
| pH = 11,1
C(NH4OH) –?
| |
| 0,15M H2SO4
| 0,7% H2S
r = 1 г/мл
| pH = 12,7; r = 1 г/мл
w(NaOH) –?
| pH = 2,8
C(H3PO4) –?
| |
| 0,08M HCl
| 0,2% H3PO4
r = 1 г/мл
| pH = 0,9; r = 1 г/мл
w(HBr) –?
| pH = 11,8
C(NH4OH) –?
| |
| 0,3M LiOH
| 0,9% H2S
r = 1 г/мл
| pH = 1,5; r = 1 г/мл
w(HCl) –?
| pH = 12,1
C(NH4OH) –?
| |
| 0,06M Ba(OH)2
| 0,5% NH4OH
r = 1 г/мл
| pH = 1,4; r = 1 г/мл
w(H2SO4) –?
| pH = 2,1
C(H2S) –?
| |
| 0,05M HCl
| 0,1% HF
r = 1 г/мл
| pH = 12,2; r = 1 г/мл
w(Ba(OH)2) –?
| pH = 4,8
C(H2CO3) –?
| |
| 0,4M H2SO4
| 0,6% H2CO3
r = 1 г/мл
| pH = 1,5; r = 1 г/мл
w(HNO3) –?
| pH = 11,8
C(NH4OH) –?
| Продолжение таблицы 6.1
| Вариант
| а) рассчитать pH
| б) рассчитать концентрацию
электролита в растворе
| |
| 0,12M HCl
| 0,8% CH3COOH
r = 1 г/мл
| pH = 11,7; r = 1 г/мл
w(Ca(OH)2) –?
| pH = 2,3
C(HF) –?
| |
| 0,4M NaOH
| 0,9% NH4OH
r = 1 г/мл
| pH = 12,5; r = 1 г/мл
w(Sr(OH)2) –?
| pH = 2,5
C(H2CO3) –?
| |
| 0,8M HCl
| 0,5% CH3COOH
r = 1 г/мл
| pH = 0,85; r = 1 г/мл
w(H2SO4) –?
| pH = 10,8
C(NH4OH) –?
| |
| 0,05M LiOH
| 0,1% NH4OH
r = 1 г/мл
| pH = 13,2; r = 1 г/мл
w(NaOH) –?
| pH = 1,2
C(H3PO4) –?
| |
| 0,06M Ba(OH)2
| 0,7% H2CO3
r = 1 г/мл
| pH = 0,2; r = 1 г/мл
w(HNO3) –?
| pH = 11,8
C(NH4OH) –?
| |
| 0,25M H2SO4
| 0,5% CH3COOH
r = 1 г/мл
| pH = 13,1; r = 1 г/мл
w(Sr(OH)2) –?
| pH = 3,8
C(H2S) –?
| |
| 0,45M HCl
| 0,3% H3PO4
r = 1 г/мл
| pH = 11,2; r = 1 г/мл
w(LiOH) –?
| pH = 1,8
C(HF) –?
| |
| 0,01M Ba(OH)2
| 0,4% NH4OH
r = 1 г/мл
| pH = 12,6; r = 1 г/мл
w(NaOH) –?
| pH = 1,4
C(H2SO3) –?
| |
| 0,02M LiOH
| 0,6% H2CO3
r = 1 г/мл
| pH = 1,4; r = 1 г/мл
w(H2SO4) –?
| pH = 11,2
C(NH4OH) –?
| |
| 0,08M Ca(OH)2
| 0,8% H3PO4
r = 1 г/мл
| pH = 13,5; r = 1 г/мл
w(Ba(OH)2) –?
| pH = 2,1
C(CH3COOH) –?
| |
| 0,3M HCl
| 0,9% NH4OH
r = 1 г/мл
| pH = 13,0; r = 1 г/мл
w(NaOH) –?
| pH = 2,8
C(H2S) –?
| |
| 0,6M Ba(OH)2
| 0,4% CH3COOH
r = 1 г/мл
| pH = 13,3; r = 1 г/мл
w(NaOH) –?
| pH = 5,5
C(H2CO3) –?
| |
| 0,08M H2SO4
| 0,7% H2CO3
r = 1 г/мл
| pH = 1,2; r = 1 г/мл
w(H2SO4) –?
| pH = 10,3
C(NH4OH) –?
| |
| 0,04M LiOH
| 0,6% H3PO4
r = 1 г/мл
| pH = 0,5; r = 1 г/мл
w(HCl) –?
| pH = 11,2
C(NH4OH) –?
|
Список литературы
1. Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для вузов / Ю.А. Ершов и др.; под ред. Ю.А. Ершова. – М.: Высшая школа, 2003. – 560 с.
2. Общая химия: методические указания и контрольные задания для студентов технологических специальностей заочной формы обучения / авт.-сост. В.А. Огородников. – Могилёв: УО «МГУП», 2012. – 48 с.
3. Лурье, Ю.Ю. Справочник по аналитической химии / Ю.Ю. Лурье. – М.: Химия, 1989. – 448 с.
4. Рабинович, В.А. Краткий химический справочник / В.А. Рабинович, З.Я. Хавин. – Л.: Химия, 1991. – 432 с.
Учебное издание
НЕОРГАНИЧЕСКАЯ ХИМИЯ БИОГЕННЫХ ЭЛЕМЕНТОВ
Методические указания
Составители:
Огородников Валерий Анатольевич
Супонева Татьяна Михайловна
Редактор А.А. Щербакова
Технический редактор Т.В. Багуцкая
Подписано в печать 18.12.2012. Формат 60×84 1/16.
Бумага офсетная. Гарнитура Таймс. Ризография.
Усл. печ. 3,5 л. Уч.-изд. 3,8 л.
Тираж 113 экз. Заказ 178.
Учреждение образования
«Могилевский государственный университет продовольствия».
ЛИ № 02330/630 от 31.01.2012 г.
Пр-т Шмидта, 3, 212027, Могилев.
Отпечатано в учреждении образования
«Могилевский государственный университет продовольствия».
Пр-т Шмидта, 3, 212027, Могилев.

Расчетные и графические задания Равновесный объем - это объем, определяемый равенством спроса и предложения...
|

Кардиналистский и ординалистский подходы Кардиналистский (количественный подход) к анализу полезности основан на представлении о возможности измерения различных благ в условных единицах полезности...
|

Обзор компонентов Multisim Компоненты – это основа любой схемы, это все элементы, из которых она состоит. Multisim оперирует с двумя категориями...
|

Композиция из абстрактных геометрических фигур Данная композиция состоит из линий, штриховки, абстрактных геометрических форм...
|
|
ПУНКЦИЯ И КАТЕТЕРИЗАЦИЯ ПОДКЛЮЧИЧНОЙ ВЕНЫ
Пункцию и катетеризацию подключичной вены обычно производит хирург или анестезиолог, иногда — специально обученный терапевт...
Ситуация 26. ПРОВЕРЕНО МИНЗДРАВОМ
Станислав Свердлов закончил российско-американский факультет менеджмента Томского государственного университета...
Различия в философии античности, средневековья и Возрождения ♦Венцом античной философии было: Единое Благо, Мировой Ум, Мировая Душа, Космос...
|
|
Что такое пропорции?
Это соотношение частей целого между собой. Что может являться частями в образе или в луке...
Растягивание костей и хрящей. Данные способы применимы в случае закрытых зон роста.
Врачи-хирурги выяснили...
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ИЗНОС ДЕТАЛЕЙ, И МЕТОДЫ СНИЖЕНИИ СКОРОСТИ ИЗНАШИВАНИЯ Кроме названных причин разрушений и износов, знание которых можно использовать в системе технического обслуживания и ремонта машин для повышения их долговечности, немаловажное значение имеют знания о причинах разрушения деталей в результате старения...
|
|