ДНК-лігаза 1 страница
Ковалентні зв’язки між кінцями ДНК утворюються під дією ДНК-лігази. Кільцева ДНК утворює суперспіралі. Суперспіралізація регулюється спеціальними білками – топоізомеразами. В клітині прокаріотів фактично немає зв’язаних білків. В той же час ДНК еукаріотів зв’язана з чисельними білками, які відіграють важливу роль у функціонуванні генетичного апарату.
2. Організація генетичного апарату еукаріотів Генетичний апарат еукаріотів являє собою дуже складно організовані нуклеопротеїдні комплекси. В їх складі ДНК взаємодіє з різними типами білків з утворенням хроматину. В стані „спокою” клітини, які не діляться, містять аморфний хроматин, розподілений у ядрі. Безпосередньо перед поділом (мітозом) хроматин реорганізовується в компактні структури (фібри), що прийнято називати хромосомами. В середньому кожна із 46 хромосом людини містить 1,3 *108 нуклеотидних пар і має довжину біля 5 см. Тобто загальна довжина геному однієї клітини людини понад 2 м. Постає запитання про те, яким чином в клітині організована ДНК та такий великий генетичний апарат? Першою стадією організації прийнято вважати утворення структури „короликів на нитці”, яка складається з ДНК, асоційованого з сильно лужними білками – гістонами. Ці білки міцно зв’язуються з ДНК з утворенням дуже стабільних комплексів, такі структури намиста виявлені при електронній мікроскопії обробленого розчинами з низькою йонною силою. Відомо п’ять типів гістонів: Н1, Н2А, Н2В, Н3 та Н4. Гістони Н2А, Н2В, Н3 та Н4 – білки з молекулярною масою 11-15 кД, Н1 – ~21 кД. Це висококонсервативні білки. У хребетних виявлено ще один гістон – Н5, функції якого близькі до таких Н1. Оскільки гістони сильно лужні, то їх взаємодія з сильно кислим поліфосфатним ланцюгом нуклеїнових кислот призводить до утворення незаряджених нуклеопротеїдів. Основу нуклеосоми складає октамер з гістонів по дві молекули: Н2А, Н2В, Н3 та Н4. Гістони взаємодіють з малою боріздкою ДНК, залишаючи велику для взаємодії з білками, що регулюють експресію ДНК та інші їх функції.
Рис. 2.1. Будова нуклеосоми.
Гістони беруть участь у суперспіралізації ДНК еукаріотів, бо, на відміну від прокаріотів, у них мало топоізомераз. В полінуклеосомах нуклеосоми з’єднані „лінкерною” (зв’язуючою) ДНК. Полінуклеосоми – періодично повторювані нуклеосоми, які складаються з гістонів і ДНК. (8.14.43, р.605). Далі полінуклеосоми укладаються в так звані 70 нм волокна, які в свою чергу, упаковуються в 30 нм волокна, які виявляються електронним мікроскопом. Вищими порядками організації є утворення соленоїдів, тощо. Окрім гістонових білків з ДНК еукаріотів зв’язані чисельні білки, які беруть участь в обміні нуклеїнових кислот та його регуляції.
3. Нуклеопротеїди прокаріотів Як правило, у клітинах прокаріотів ДНК організована в одну хромосому, яка є кільцевою подвійною суперспіраллю. Проте, деякі бактерії можуть мати більше, ніж одну хромосому і остання може бути лінійною. У прокаріотів немає гістонів, але натомість вони мають білок НU з молекулярною масою ~18кД, який подібний до гістонів. Він існує як гетеродимер з двох майже ідентичних субодиниць НU1 та НU2. Зв’язування НU з ДНК in vitro компактує нуклеїнові кислоти і утворює суперспіраль, причому ступінь ефекту залежить від концентрації нуклеїнових кислот. Ще один розповсюджений подібний до гістонів білок Н-NS також може бути відповідальним за організацію хромосоми або безпосередньо, взаємодіючи з ДНК, або опосередковано – через НU-білки. Бактеріальні хромосоми організовані в компактні структури – нуклеоїди, вони стабілізуються, взаємодіючи з білками та РНК. У випадку Е. соli нуклеоїд складається з приблизно 100 основ ДНК, упакованих в гілкоподібні структури з білком та РНК (від? 14.46 р. 609). Геном E. coli складається з ~4,5 *106 основ, які при лінеаризації матимуть довжину 1,5 нм, що в 80 раз довше клітини бактерії. Хоча нуклеоїд по аналогії з хроматином еукаріотів організований в петлеподібні домени, ці структури далі не компактуються, як у еукаріотів. Хромосоми бактерій динамічні, вони утворені з ДНК та подібних до гістонів білків, які можуть швидко дисоціювати. Це може бути пов’язане з потребою швидкого синтезу ДНК, поділом клітини та переходами, що характерні для бактерій. На протилежність цьому, гістони зв’язані з ДНК еукаріотів сильніше, тому можуть дисоціювати тільки в тих частинах геному, які задіяні у синтезі ДНК, репарації, рекомбінації чи транскрипції. Більшість ДНК прокаріотів кодує специфічні білки. Решту складають регуляторні області тощо. В еукаріотів для кодування всіх генів достатньо тільки біля 10% ДНК. Решту складає ДНК центромер і теломер, але функції основної частини невідомі, хоча вони можуть відігравати певну роль в регуляції експресії генів у процесі розвитку. 4. ДНК мітохондрій (мітДНК = мДНК) мДНК – невелика подвійна замкнена структура, що містить біля 16500 пар основ. У ссавців мДНК становить близько 1% загального вмісту ДНК в клітині. В мітохондріях є багато копій ДНК, зазвичай, розподілених у кількох кластерах. Загальна кількість копій на клітину може сягати 1000. Швидше всього геном мітохондрій організований за принципами такого прокаріотів, а саме: · бактеріальний і мітохондріальний геноми складаються із замкнених молекул ДНК; · бактеріальні та мітохондріальні геноми не є безперервними; · мітохондріальні іРНК не піддаються процесингу, тобто кепіюванню на 5’- та поліаденілюванню на 3’-кінці; · деякі триплети мітохондріальної ДНК кодують амінокислоти у спосіб, відмінний від такого у ядерної ДНК. Аналіз послідовностей мДНК може дати унікальну інформацію про походження клітини чи організму. Це можна проілюструвати двома факторами:
мДНК, потрапляючи в ядро, може вмонтовуватись в ядерні гени, утворюючи химерні послідовності. У ссавців багато мітохондріальних генів перейшли в ядро. Про це свідчить вище відношення мітохондріальна/ядерна ДНК у рослин і жаб, порівняно із таким у ссавців. З іншого боку мітохондріальний геном не є автономним, адже багато білків, які кодуються ядерною ДНК, необхідні для реплікації мДНК і транскрипції. Отже, немітохондріальні гени абсолютно необхідні для нормального функціонування мітохондрій. Тому мутації геномної ДНК можуть викликати мітохондріальні хвороби, хоча й дихання клітини регулюється мітохондріальним геномом. мДНК людини містить – 16569 пар основ і 37 генів. 13 з них кодують білки, які є субодиницями факторів, необхідних для підтримки синтезу АТФ мітохондріями, решта 24 гени кодують специфічні для мітохондрій РНК (2 рибосомальні – 12S та 16S і 22 транспортні РНК). Швидкість мутації мДНК в 10 раз вища, ніж ядерної. Ця висока частота мутацій, імовірно, віддзеркалює низьку точність реплікації ДНК, її репарації, або обох процесів разом. Крім того мДНК піддається більш інтенсивній дії ендогенних мутагенів –активних форм кисню (АФК). Останні утворюються в мітохондріях як побічний продукт метаболізму О2. Мітохондріальні гени наслідуються по материнській лінії, бо мітохондрії сперматозоїдів при заплідненні не входять в яйцеклітину. Лекція 3 СИНТЕЗ ДНК
1.Утворення фосфодиефірного зв’язку каталізується ДНК–залежною ДНК-полімеразою. В E. coli є 3 форми I, II, III, які відповідно і називаються: Pol I, Pol II, Pol III.
Властивості ДНК-полімерази E. coli: Pol I Pol II Pol III Полімеризація: 5´à3´ + + + Екзонуклеаза: 5´à3´ + + + Екзонуклеаза: 3´à5´ + - - Молекулярна маса (КД): 103 90 (167 – α-, 130 – ε-, 27,5 – θ-, 10 – τ-субодиниці) Кількість в одній клітині 400 - 10-20 Число обертів 600 30 9000 (нукл. 370С(хв/мол. ферм.)) Структурний ген Pol A Pol B Pol C
Pol III здійснює синтез ДНК, Pol I – синтез і репарацію ДНК, а Pol II каталізує репарацію, але її функція дуже високоспецифічна.
 
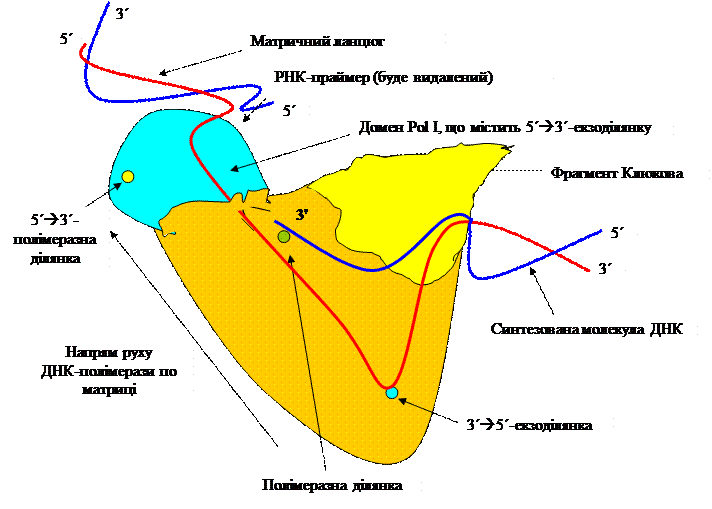
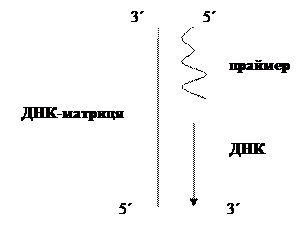
Рис. 3.1. Синтез праймера на матриці. ДНК-полімераза каталізує полімеризацію нуклеотидів у напрямку 5´à3´. Фосфодиефірний зв’язок утворюється між вільною 3´-гідроксильною групою нарощуваного ланцюга (праймер) і відповідним дезоксирибонуклеозидо-5´-трифосфатом. При цьому відщеплюється пірофосфат. Для функціонування ДНК-полімераза потребує матрицю, праймер і, звичайно, дезоксинуклеозидтрифосфати. Помилки у приєднанні нуклеотидів ДНК-полімеразою відбуваються, в основному, через іонізацію азотистих основ. Тобто, однією з причин помилок є кетоенольна таутомеризація азотистих основ. Некоректне приєднання відбувається з частотою 104-105 нуклеотидів. Експериментально визначена частота складає ~10-8. Різниця в цифрах забезпечується корекцією невірно приєднаних нуклеотидів. Тобто існує механізм видалення полімеразою некоректно вставлених нуклетидів. Видалення некоректного фрагменту каталізується 3´à5´-екзонуклеазною активністю, характерною для Pol I. Це дозволяє припустити, що корекція необхідна для точного синтезу ДНК. У зв’язку з цим активна полімераза може тимчасово обернути синтетичні активності і функціонувати як екзонуклеаза. В результаті високої точності нескоректованим залишається менше 1 із 1000 невірно приєднаних нуклеотидів. ДНК-полімераза I E. coli має 3 різні активності 5´à3´-синтетазну, і 3´à5´- і 5´à3´-екзонуклеазні. Вони забезпечуються трьома різними активними центрами ферменту.
Рис. 3.2. Структура ДНК-полімерази І.
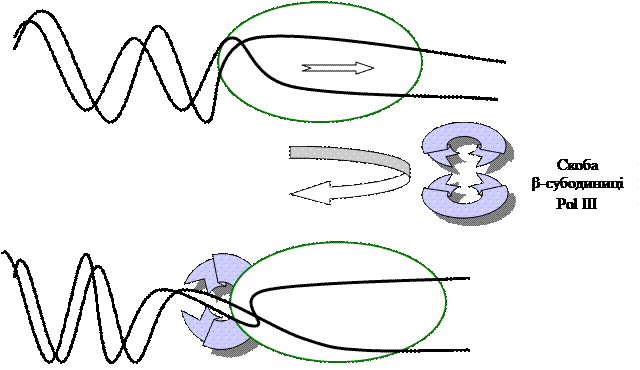
Однією з важливих характеристик ДНК-полімераз є їхня здатність залишатися зв’язаною з матрицею після приєднання чергового нуклеотиду, а не дисоціювати і зв’язуватись з іншою подібною ділянкою ДНК. Ця особливість ДНК-полімерази називається процесивністю. Полімераза III E. coli не тільки швидше каталізує полімеризацію, але й має вищу процесивність. Вони виконують різні функції. Особлива роль належить β-субодиниці Pol III – вона утворює щось на зразок скоби із двох субодиниць кругом матриці. Це дозволяє олігомерному ансамблю повзти вздовж між ДНК без дисоціації від матриці.
Рис. 3.3. Елонгація ланцюга ДНК.
Зв’язування каталітичного кору зі скобою β-субодиниці утворює зв’язаний з матрицею холофермент полімерази III, що є повністю функціонально активним комплексом. Саме утворення скоби відповідає за надзвичайно високу процесивність ДНК-полімерази III. ДНК-полімераза еукаріотів Із клітин ссавців ізольовано 5 типів ДНК-полімераз: α, β, δ і ε здійснюють синтез та репарацію хромосомної ДНК, γ-ДНК-полімераза, знайдена в мітохондріях. Всі 5 ДНК-полімераз еукаріотів мають 5´à3´-синтетазну активність, але не всі мають коригуючу. Тільки полімераза ε є первинно репараційним ферментом подібно до ДНК-полімерази I E. coli. Тобто вона здійснює 5´à3´-синтетичну реакцію, а також 3´à5´- та 5´à3´-екзонуклеазну. Полімераза β має 5´à3´-синтетазну та 5´à3´-екзонуклеазну, тому вона не функціонує як репараза. Всі ДНК-полімерази еукаріотів функціонують скоординовано і з дуже високою точністю.
2. Реплікація ДНК Всі відомі ДНК-полімерази здійснюють синтез молекули ДНК тільки в 5´à3´-напрямку. Проте, практично для всіх необхідна наявність двох ланцюгів ДНК. Далі – всі вони потребують затравку (праймер) і реплікація не може початись поки подвійна спіраль не розділена. Розділення ланцюгів вимагає енергії для розриву термодинамічно вигідних стабільних комплексів. Найбільш детально вивчена реплікація у кишкової палички E. coli, тому саме інформація, отримана на даному мікроорганізмі, буде надана в першу чергу, а пізніше будуть приведені деякі особливості реплікації у еукаріотів. Реплікація є напівконсервативним процесом. Це означає, що в кожну з дочірніх молекул потрапляє по одному ланцюгу з материнської молекули.
Рис. 3.4. Загальна схема реплікації.
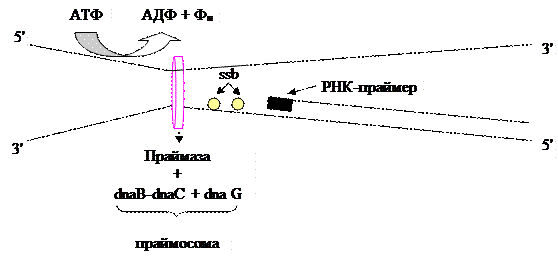
Для початку синтезу необхідно утворення праймера. Він синтезується, як правило, спеціальним ферментом – праймазою. В деяких випадках синтез праймера може здійснювати РНК-полімераза. У E. coli праймер містить 10-60 нуклеотидів. Як правило, праймази використовують рибонуклеотиди. Але багато з вивчених праймаз не роблять різниці між 5´-рибо- та 5´-дезоксирибонуклеотидами. Праймази не мають активності корекції помилок і синтезують фрагменти нуклеїнових кислот з відносно великою кількістю помилок. Проте, це не дуже важливо, бо утворені фрагменти надалі будуть вирізані.
Рис. 3.5. Реплікативна вилка.
Рис. 3.6. Участь різних ферментів у реплікації.
Подвійний ланцюг розплітає геліказа (helicase) – розплітаза. У E. coli відомо геліказу II та rep-білок. Гелікази рухаються в одному напрямку вздовж молекули ДНК і розділюють ланцюг, підготовлюючи його до реплікації. Вони дестабілізують взаємодію між комплементарними основами за рахунок енергії АТФ. Геліказа рухається перед реплікативною вилкою, а за нею зразу ж – білки, які зв’язуються з одноланцюговою ДНК. Як тільки ланцюги ДНК розійшлись, в цьому стані вони стабілізуються спеціальними білками, які зв’язуються з одноланцюговими молекулами ДНК з високою спорідненістю. Ці білки не використовують енергію і не мають відомої ферментативної активності. Їх роль – утримувати одиночні ланцюги ДНК і не давати їм зв’язуватись знову. Ці білки називаються ssb (від англ. Single Stand Binding). Для ДНК E. coli розраховано, що подвійна спіраль повинна розкручуватись зі швидкістю 6000 обертів за хвилину. Це вимагає дуже великих затрат енергії. Потреба в енергії може бути знижена за рахунок контрольованого розрізання одного чи двох ланцюгів ДНК. Розплітання подвійної спіралі в місці реплікативної вилки викликає суперспіралізацію решти молекули ДНК. Якби не було надрізання, то суперспіралізація в якийсь момент унеможливила б подальшу реплікацію. Надрізана молекула ДНК тут же з’єднується. В процесі реплікації беруть також участь топоізомерази, які регулюють суперспіралізацію молекули ДНК.
3. Реплікація у E. coli E. coli – модельний об’єкт для вивчення реплікації ДНК. У цих мікрорганізмів найповніше вивчено механізм реплікації. В ньому бере участь велика кількість білків. Частина з них приведена в таблиці.
Компоненти реплісоми кишкової палички E. coli
Білок Функція ssb білки з високою спорідненістю до одноланцюгової ДНК (Single Stand Binding)
білок i (dna T) білок n білок n/ білок n//
dna G праймаза (синтез праймера)
Pol III (голофермент) процесивна елонгація
Pol I заповнення дірок і вирізання праймера лігаза лігування
гіраза gyr А gyr В rep
гелікaза II dna B
dna A dna B
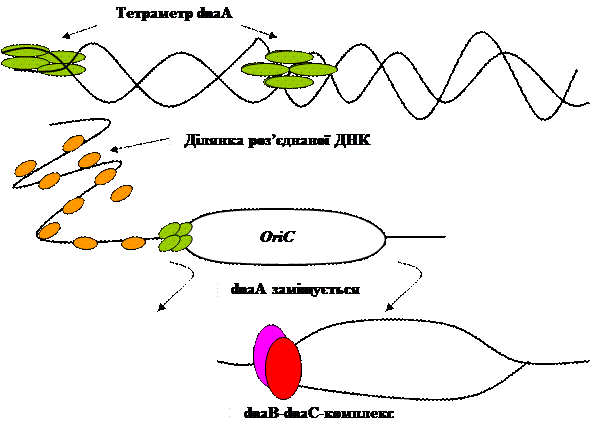
Ініціація синтезу ДНК та сам синтез Синтез ДНК в E. coli починається в специфічному місці хромосоми oriC (Replication Origin). Для початку процесу необхідна наявність у даному місці 20-30 різних білків, причому багато з них мають бути у великій кількості копій. Місце оriC розпізнається специфічними білками, причому це місце повинно розкрутитись, щоб дозволити геліказі, праймазі та ДНК-полімеразі III мати доступ до кожного ланцюга ДНК. OriC має 245 пар нуклеотидів і містить чотири ділянки, в яких для ініціації реплікації повинен зв’язатись тетрамерний білок dnaA. Це місце має також 11 точок метилювання, які розпізнаються Dam-метилазою і три багаті АТ-пароми – тандемні повтори. Такий ансамбль називається реплісомою. Утворення реплісоми починається зі зв’язування однієї молекули dnaA з однією із спеціальних ділянок (9-mers) за умови, що ці ділянки повністю метильовані. Білок HU також бере участь в утворенні комплексу. DnaA та HU взаємодіють з ДНК так, що розкриваються ланцюги ДНК в багатьох АТ-місцях. Далі dnaA з допомогою dnaC додає до комплексу dnaB. Останній завдяки геліказній активності створює місце початкового розходження двох ланцюгів в кількасот пар нуклеотидів. Енергія, необхідна для розриву ланцюгів, береться за рахунок гідролізу АТФ в реакції, що каталізується топоізомеразою II. Після розходження двох ланцюгів вони стабілізуються ssb-білками.
Рис. 3.7. Утворення реплісоми на ДНК.
Синтез праймерної РНК починається з утворення препраймерного комплексу. Він складається з комплексу dnaB-dnaC до якого додаються інші білки (n, n/, n//, i). Додавання праймази – dna G перетворює препраймерний комплекс в праймосому.
Рис.3.8. Утворення праймосоми та синтез РНК-праймера.
Праймосома взаємодіє з матрицею, причому в кожній з двох утворених вилок утворюється два „пухирці”. Після цього припиняється синтез РНК праймерів на двох лідируючих ланцюгах. Утворення реплісоми з праймосоми закінчується додаванням до праймосоми ДНК-полімерази III і rep-білків. Ініціація регулюється або обмеженням доступності dnaA-зв’язуючих ділянок oriC, або недостатньою концентрацією dnaA-білка. Метилювання забезпечує перемикання для доступності dnaA-зв’язуючих ділянок. Як тільки реплікація почалась, dnaA біля oriC зв’язується з плазматичною мембраною і стає недоступним для Dam-метилази. На додаток зв’язування ДНК поблизу oriC з клітинною мембраною ізолює ген dnaА, який знаходиться близько від oriC на відстані 40 пар основ. В результаті цього синтез білка dnaА блокується і знижується його внутрішньоклітинна концентрація. Синтез ДНК забезпечується ДНК-полімеразою III. Проте, коли мова піде про з’єднання фрагментів Оказакі, то праймер попереднього фрагменту „вирізається” ДНК-полімеразою I. На звільненій частині матриці цей же фермент синтезує ДНК і репарований фрагмент зшивається з рештою нової молекули ДНК-ліпазою з утворенням інтактної ДНК. Термінація синтезу ДНК Термінація відбувається в локусі ter або τ;. Він складається з 5 так званих ter -послідовностей, з якими зв’язуються Tus-білки (Terminator Utilitation Substance), які забезпечують термінацію синтезу. Tus-білки є контрагеліказами. Вони протидіють АТФ-залежній і dnaВ-геліказам, що розкручують спіраль. Кожна з Tus-ділянок має асиметрію і саме через це вона блокує реплісому, яка досягає Tus-ділянки з одного специфічного напрямку. Синтезована нова молекула ДНК „відплутується” від материнської молекули під дією топоізомерази II.
Рух вилки реплікації проти годинникової стрілки
Рух вилки реплікації за годинниковою стрілкою
Рис. 3.9. Термінація синтезу ДНК. 4. Реплікація ДНК еукаріотів В цілому реплікація у еукаріотів близька до такої в прокаріотів. Проте всі процеси організовані дещо складніше. У еукаріотів – від дріжджів і до людини синтез ДНК починається практично зразу ж, після закінчення попереднього. На протилежність, в еукаріотів, синтез ДНК (і гістонів) відбувається лишень в одній специфічній фазі клітинного циклу інтерфази – S (syntetic). S-фаза межує з двома G-фазами – G1 та G2 (Gap – пропуск, період, інтервал). Особливості реплікації ДНК еукаріотів пов’язані зі значно більшими розмірами молекули ДНК – 105 -106 тис. пар основ, в порівнянні з ДНК прокаріотів – у E. coli 5*103 тис. пар. Різниця також є наслідком різної укладки ДНК, а також тим, що реплікативна вилка в еукаріотів рухається значно повільніше, ніж у прокаріотів. Швидкість руху вилки низька і для того, щоб ДНК стала доступною для ДНК-полімерази, необхідно „розібрати” нуклеосому. ДНК-полімераза еукаріотів каталізує приєднання 30000 основ на хвилину, що значно менше, ніж у прокаріотів (<<10 разів). Виходячи з всього цього, можна було б очікувати, що реплікація ДНК в еукаріотів мала б тривати місяці. Проте, існують фактори, які значно прискорюють процес. Він відбувається протягом годин. Так, в клітині еукаріотів є дуже багато молекул ДНК-полімерази – часто понад 20000. У E. coli їх кілька десятків. ДНК-полімераза ініціює двонаправлений синтез ДНК, але існує кілька місць початку реплікації. Вони локалізуються по відстані 5-300 тис. пар основ. Сегменти ДНК між двома місцями початку реплікації називаються реплікосомами. В середньому хромосома людини містить біля 200 реплікаційних вилок. Білок lacA інактивується RecA-протеазою, але тільки в результаті пошкодження ДНК, оскільки при активації SOS-системи збільшується активність репараз, зокрема, UmuD. Вона здатна репарувати ДНК без матриці. В результаті з’являється багато мутацій. SOS-система активується при пошкодженні ДНК, що мобілізує механізми репарації. Після репарації ДНК система вимикається і може відбуватись подальший мутагенез. На додаток до цієї функції, SOS-регуляторна система відіграє центральну роль в реплікації помірних вірусів. В нормі системи репарації використовують для репарації пошкодженої молекули ДНК інший комплементарний ланцюг. Системи, які репарують без матриці, функціонують, в основному, коли бракує потужності перших систем поправити пошкодження великої кількості ДНК.
5. Реплікація ДНК на кінцях лінійних хромосом
Рис. 3.10. Реплікація ДНК на кінцях лінійних хромосом.
Для початку синтезу молекули ДНК потрібна затравка – праймер. При закінченні синтезу лінійної молекули на 5´-кінці нової молекули утворюється ділянка, яку займає праймер.Оскільки ДНК-полімераза не має 3´à5´-полімеразної активності, то 5´-кінець нової синтезованої молекули буде незаповненим. З кожним циклом поділу клітини хромосома буде вкорочуватись на 5´-кінці і це буде відбуватись до тих пір, поки не відіб’ється на функціонально важливій ділянці хромосоми і клітина втратить здатність виживати. Саме в цьому і полягає одна із гіпотез теорії про обмеження тривалості життя. Для вирішення даної проблеми у організмів виробились різні стратегії. Лінійна ДНК вірусів, плазмід та органел синтезується по-різному. Так, в одному з механізмів використовується термінальний білок (TP – Terminal Protein). Він ковалентно зв’язується з 3´-кінцем вірусної ДНК через фосфодиефірний зв’язок з гідроксильною групою серину. Для різних вірусів характерні різні типи ТР-білків.
Рис. 3.11. Реплікація ДНК аденовірусу.
У бактеріофага α-29 використовується дАМФ. По суті праймером слугує мононуклеотид в комплексі з ДНК (3´-кінець) і ТР-білком. Спеціальна полімераза розпізнає цей комплекс і кожен ланцюг ДНК слугує матрицею. При закінченні синтезу молекула ТР відходить від молекули ДНК. Інші віруси утворюють кругові інтермедіати, які копіюються подібно до бактеріальних ДНК. Деякі віруси з ідентичними послідовностями на кільцях молекул ДНК можуть гібридизувати їх. Лінійна ДНК з комплементарними одноланцюговими кінцями (липкі, клейкі кінці) може циклізуватись з утворенням комплементарних кінців.
Рис. 3.12. Циклізація вірусної ДНК.
Кілька типів вірусів і багато лінійних плазмід „вирішили” проблему реплікації ДНК, використовуючи в якості праймера не РНК, а білок. Хоча практично всі ДНК-полімерази додають кожен наступний нуклеотид до вільної ОН-групи, деякі ферменти цього класу можуть приєднати перший нуклеотид до ОН-групи специфічного білка. Цей спеціальний білок зв’язаний з кінцем цієї лінійної хромосоми. Даний тип білків кодується плазмідами чи вірусами і їх функція полягає у розпізнанні кінців хромосоми і ковалентному з’єднанні з її 5´-кінцем. В цьому випадку білковий праймер не відділяється від ДНК, а залишається зв’язаним з нею постійно. Деякі бактерії з лінійними хромосомами, наприклад Streptomyces lividans, використовують саме такий механізм реплікації.
Рис. 3.13. Реплікація вірусної ДНК з участю білка в ролі праймера.
Деякі віруси мають прямі повтори на кожному з кінців хромосоми. Процес рекомбінації (з’єднання різних молекул ДНК) використовує ці повтори для з’єднання
|




 Обидва ланцюги ДНК одночасно служать матрицею для синтезу. Тобто, синтез ДНК відбувається одночасно на двох ланцюгах, але, звичайно ж, в двох протилежних напрямках. Синтез ДНК здійснюється безперервно у двох напрямках. У бактерій з їх циклічною молекулою ДНК реплікативні вилки рухаються в двох напрямках, поки не „зустрінуться”. При цьому закінчуються синтез ДНК і дві молекули розходяться. Середня швидкість, з якою рухається реплікативна вилка ~60000 основ.
Обидва ланцюги ДНК одночасно служать матрицею для синтезу. Тобто, синтез ДНК відбувається одночасно на двох ланцюгах, але, звичайно ж, в двох протилежних напрямках. Синтез ДНК здійснюється безперервно у двох напрямках. У бактерій з їх циклічною молекулою ДНК реплікативні вилки рухаються в двох напрямках, поки не „зустрінуться”. При цьому закінчуються синтез ДНК і дві молекули розходяться. Середня швидкість, з якою рухається реплікативна вилка ~60000 основ.