Ковалентные связи с участием атома углерода
В основном состоянии атом углерода С (1s22s22p2) имеет два неспаренных электрона, за счет которых могут образовывать только две общие электронные пары. Однако в большинстве своих соединений углерод четырехвалентен. Это объясняется тем, что атом углерода, поглощая небольшое количество энергии, переходит в возбужденное состояние, в котором он имеет 4 неспаренных электрона, т.е. способен образовывать четыре ковалентные связи и принимать участие в формировании четырех общих электронных пар: 6С 1 s 2 2s2 2 p 2
Энергия возбуждения компенсируется образованием химических связей, которое происходит с выделением энергии. Атомы углерода обладают способностью к образованию трех видов гибридизации электронных орбиталей (sp3, sp2, sp) и образованию между собой кратных (двойных и тройных) связей (табл.7). Таблица 7 Типы гибридизации и геометрия молекул
Простая (одинарная) s - связь осуществляется при sp3 -гибридизации, при которой все четыре гибридных орбитали равноценны и имеют направленность в пространстве под углом 109о29’ друг к другу и ориентированы к вершинам правильного тетраэдра.
Рис. 19. Образование молекулы метана СН4 Если гибридные орбитали углерода перекрываются с шарообразными s -орбиталями атома водорода, то образуется простейшее органическое соединение метан СН4 – предельный углеводород (рис. 19).
Рис. 20. Тетраэдрическое расположение связей в молекуле метана
Большой интерес представляет изучение связей атомов углерода между собой и с атомами других элементов. Рассмотрим строение молекул этана, этилена и ацетилена. Углы между всеми связями в молекуле этана почти точно равны между собой (рис. 21) и не отличаются от углов С-Н в молекуле метана.
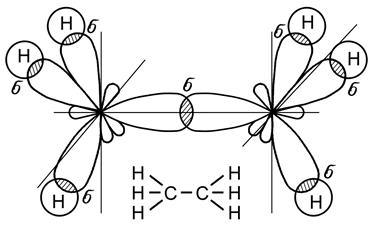
Рис. 21. Молекула этана С2Н6 Следовательно, атомы углерода находятся в состоянии sp3 -гибридизации. Гибридизация электронных орбиталей атомов углерода может быть и неполной, т.е. в ней могут участвовать две (sp2 –гибридизация) или одна (sp -гибридизация) из трех р - орбиталей. В этом случае между атомами углерода образуются кратные (двойная или тройная) связи. Углеводороды с кратными связями называются непредельными или ненасыщенными. Двойная связь (С = С) образуется при sp2 – гибридизации. В этом случае у каждого из атомов углерода одна из трех р - орбиталей не участвует в гибридизации, в результате образуются три sp2 – гибридные орбитали, расположенные в одной плоскости под углом 120о друг к другу, а негибридная 2 р -орбиталь располагается перпендикулярно этой плоскости. Два атома углерода соединяются между собой, образуя одну s-связь за счет перекрывания гибридных орбиталей и одну p-связь за счет перекрывания р -орбиталей. Взаимодействие свободных гибридных орбиталей углерода с 1s-орбиталями атомов водорода приводит к образованию молекулы этилена С2Н4 (рис. 22), - простейшего представителя непредельных углеводородов.
Рис. 22. Образование молекулы этилена С2Н4
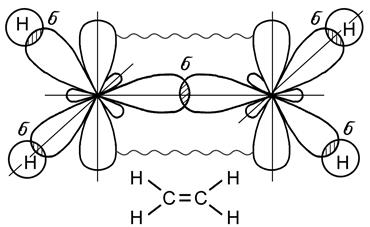
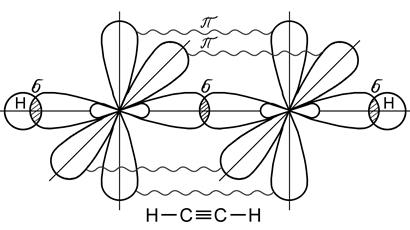
Перекрывание электронных орбиталей в случае p - связи меньше и зоны с повышенной электронной плотностью лежат дальше от ядер атомов, поэтому эта связь менее прочная, чем s - связь. Тройная связь образуется за счет одной s - связи и двух p - связей. Электронные орбитали при этом находятся в состоянии sp-гибридизации, образование которой происходит за счет одной s - и одной р - орбиталей (рис. 23).
Рис. 23. Образование молекулы ацетилена С2Н2
Две гибридные орбитали располагаются под углом 180о относительно друг друга, а оставшиеся негибридные две р -орбитали располагаются в двух взаимно перпендикулярных плоскостях. Образование тройной связи имеет место в молекуле ацетилена С2Н2. Особый вид связи возникает при образовании молекулы бензола (С6Н6) – простейшего представителя ароматических углеводородов. Бензол содержит шесть атомов углерода, связанных между собой в цикл (бензольное кольцо), при этом каждый атом углерода находится в состоянии sp2 -гибридизации (рис. 24). Все атомы углерода, входящие в молекулу бензола расположены в одной плоскости. У каждого атома углерода в состоянии sp2-гибридизации имеется еще одна негибридная р-орбиталь с неспаренным электроном, которая образует p - связь (рис. 25). Ось такой р - орбитали расположена перпендикулярно плоскости молекулы бензола.
Рис. 24. sp2 – орбитали молекулы бензола С6Н6
Рис. 25. Все шесть негибридных р-орбиталей образуют общую связывающую молекулярную p - орбиталь, а все шесть электронов объединяются в p - электронный секстет. Граничная поверхность такой орбитали расположена над и под плоскостью углеродного s - скелета. В результате кругового перекрывания возникает единая делокализованная p - система, охватывающая все углеродные атомы цикла. Бензол схематически изображают в виде шестиугольника с кольцом внутри, которое указывает на то, что имеет место делокализация электронов и соответствующих связей.
|

 6С* 1 s 2 2s1 2 p 3
6С* 1 s 2 2s1 2 p 3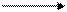 1
1


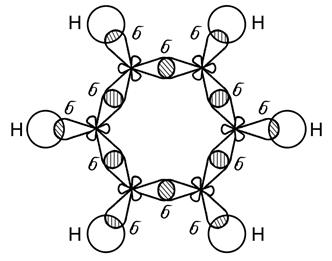
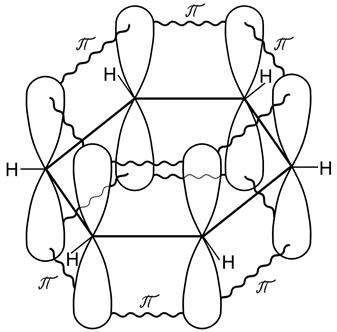
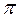 - связи в молекуле бензола С6Н6
- связи в молекуле бензола С6Н6


