
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
A working definition of autonomy
Дата добавления: 2015-08-17; просмотров: 588
|
|
Найти решение системы линейных уравнений прямым и итерационным методами и сравнить полученные результаты.
1. 
2. 
3. 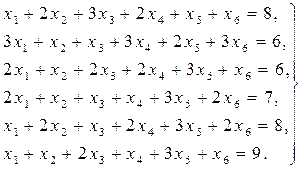
4. 
5. 
6. 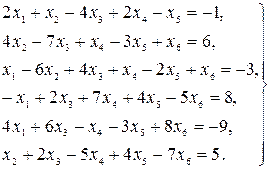
7. 
8. 
9. 
10. 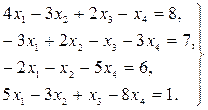
11. 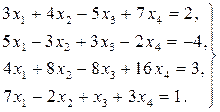
12. 
13. 
14. 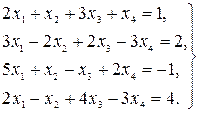
15. 
16. 

17. 
18. 
19. 
20. 
21. 
22. 
23. 
24. 
25. 
26. 
27. 
28. 
29. 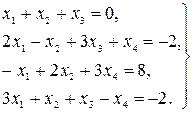
30. 
Лабораторная работа № 3
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Соединения сложного состава, в которых можно выделить центральный атом и непосредственно связанные с ним молекулы или ионы называются комплексными или координационными соединениями. Существование комплексных соединений было установлено Альфредом Вернером, награжденным в 1913 году Нобелевской премией за разработку химии координационных соединений.
Строение комплексных соединений.


 K3+[Fe3+(CN)6−] [Co3+(NH3)60]Cl3−
K3+[Fe3+(CN)6−] [Co3+(NH3)60]Cl3−

лиганды лиганды
комплексообразователь комплексообразователь
Fe3+, Co3+ - комплексообразователь, всегда пишется на первом месте после квадратных скобок. Комплексообразователем, как правило, являются металлы и чаще всего d-элементы, но существует целый ряд комплексных соединений, где центральным атомом служит неметалл – Si, P, As.
CN−, NH30 – лиганды, молекулы или ионы, окружающие центральный атом, представлены нейтральными молекулами или анионами. Лигандами могут быть и сложные органические соединения.
[Fe3+(CN)6−]3−, [Co3+(NH3)60]3+ - комплексный ион или внутренняя сфера, в зависимости от степени окисления может быть комплексным катионом, комплексным анионом, электронейтральным комплексом.
K+, Cl− - ионы составляющие внешнею сферу.
Координационное число комплексообразователя – это число атомов лигандов, координированных вокруг центрального атома, обычно бывает четным числом (2,4,6,8). Координационное число центрального атома металлы не связано с его степенью окисления, но, как правило, превышает её.
В зависимости от числа донорных атомов лиганда, различают моно-, би- и полидентантные лиганды. Лиганды, координирующиеся через два или более донорных атомов к одному центральному атому, называются хелатными.
Комплексные соединения, в которых два или более комплексообразователя, называются би- или полиядерными комплексными соединениями – [Sn2(OH)2]2+, [Sn3(OH)4]2+, чаще всего данные комплексы образуются при гидролизе.
Написание комплексных соединений
При написании формулы внутренней сферы на первом месте после квадратных скобок пишется центральный атом, т.е. комплексообразователь. Затем лиганды с указанием их числа –n, если лиганды разные, то они записываются в следующем порядке – нейтральные лиганды с указанием их числа, потом анионы, также с указанием их числа.
Например:
[Co3+(NH3)50 Cl−]2+, [Pt4+(NH3)40Cl2−]2+
При составлении формулы комплексного соединения индексы следует расставить таким образом, чтобы сумма всех зарядов была равна нулю.
Например:
K22+[Pt4+(OH)6−]2−
Классификация комплексных соединений
В зависимости от заряда комплексного иона комплексные соединения делятся на катионные, анионные и нейтральные:
| катионные | анионные | нейтральные |
| [Cu(NH3)4]2+(OH)2− [Ni(H2O)4]2+Cl2− [Cr(H2O)5Cl]2+Cl2− | K2+[PtF6]2− K3+[Co(CN)6]3− Na2+[PdCl6]2− | [Ni(CO)4] [Pt(NH3)2Cl2] [Fe(NH3)4Cl2] |
Также комплексные соединения делятся на кислоты, основания и соли.
Номенклатура комплексных соединений
Образование названий анионных и катионных комплексов отличается. Название катионного комплекса начинают записывать с названия внешней сферы, затем одним словом пишется название комплексного катиона, начало которого составляет название лигандов с указанием их числа, обозначаемого префиксами – ди-, три-, тетра-, пента-, гекса-. Последним записывают комплексообразователь с указанием степени окисления римской цифрой.
Например:
[Cu(NH3)4](OH)2 − гидроксид тетраамминмеди(II)
[Cr(H2O)5Cl]Cl2 − хлорид хлоропентааквахрома(III)
[Co(NH3)4(NO2)Cl]NO3 − нитрат хлоронитротетраамминкобальта(III)
Образование названий анионных комплексов начинают с названия комплексного аниона в соответствии с теми же правилами, что и названия комплексного катиона, но с добавлением суффикса «ат» к названию комплексообразователя. Затем называют ионы внешней сферы.
Например:
K3[Co(CN)6] − гексацианокобальтат(III) калия
K[Pt(NH3)Cl3] − трихлороамминплатинат(II) калия
K[Au(CN)2] − дицианоаурат(I) калия
Образование названий нейтральных комплексов начинается с названия и числа лигандов, затем называется комплексообразователь и его степень окисления.
Например:
[Ni(CO)4] − тетракарбонилникеля
[Pt(NH3)2Cl2] − дихлородиамминплатины(II)
Таблица 1
Названия лигандов
| лиганды | название |
| H2O NH3 CO NO CS OH− F− Cl− Br− I− CN− NCS− NO2− | аква- амин- карбонил- нитрозил- тиокарбонил- гидроксо- фторо- хлоро- бромо- йодо- циано- тиоциано- (родано-) нитро- |
Пространственное строение комплексных соединений
В пространстве комплексные ионы имеют форму многогранников (в соответствии с моделью Кеперта атом металла лежит в центре многогранника, а лиганды располагаются в вершинах многогранника). Возможны следующие конфигурации:
- линейное расположение – комплексы с координационным числом 2 − [CuCl2]−, [Ag(CN)2]−.
- плоский равносторонний треугольник – комплексы с координационным числом 3 − [HgI3]−.
- тетраэдрическая конфигурация – комплексы с координационным числом 4 − [BF4]−.
- плоский квадрат – комплексы с координационным числом 4 − [Pt(NH3)2Cl2].
- тригонально-бипирамидальная конфигурация - комплексы с координационным числом 5 − [Fe(CO)5].
- октаэдрическая конфигурация − комплексы с координационным числом 6 − [PtCl6]2−.
Изомерия комплексных соединений.
Рассматривают два типа изомерии комплексных соединений. Первый тип изомеров – при котором состав внутренней сферы не изменяется, это может быть пространственная или оптическая изомерия.
Например:
Пространственные изомеры комплексного соединения [Pt(NH3)2Cl2]
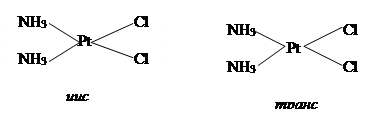
Второй тип комплексных изомеров – при котором меняется состав внутренней сферы – ионизационная, гидратная изомерия.
Например:
Гидратная изомерия комплексного соединения [Cr(H2O)6]Cl3:
[Cr(H2O)5Cl]Cl2 ∙ H2O, [Cr(H2O)4Cl2]Cl∙2H2O
Устойчивость комплексных соединений
В водном растворе диссоциация комплексных соединений протекает полностью на внешнию сферу и комплексный ион. Диссоциация комплексного иона протекает незначительно и характеризуется так называемой константой нестойкости.
[Fe(CN)6]4− ↔ Fe2+ + 6CN−

| <== предыдущая лекция | | | следующая лекция ==> |
| Attempts to describe an autonomous learner | | | A working description of an autonomous learner |