
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
A working description of an autonomous learner
Дата добавления: 2015-08-17; просмотров: 550
|
|
Опыт 1. Определение устойчивости комплексного иона
В одну пробирку внесите 5-6 капель раствора хлорида железа (III) и добавьте, 2-3 капли роданида калия. Напишите уравнения реакции в молекулярной и ионной формах, координационное число (к.ч.) комплексообразователя равно 2. Составьте выражение константы нестойкости, выпишите численное значение Кн из справочника.
Во вторую внесите 5-6 капель гексацианоферрата(III)калия (красная кровяная соль) и добавьте 2-3 капли роданида калия. Объясните, почему в этом случае не образуется комплекс кроваво-красного цвета, как в первой пробирке, для этого составьте выражение константы нестойкости комплексного иона гексацианоферрата(III)калия, выпишите численное значение Кн из справочника. Сравните Кн комплексов в двух пробирках.
Опыт 2. Получение амино-комплекса меди
В пробирку внесите 10 капель сульфата меди и 1-2 капли гидроксида аммония, образовавшийся голубой осадок растворите в избытке гидроксида аммония до образования комплексного соединения ярко- фиолетового цвета. Составьте уравнения реакций в молекулярном и ионном виде, учитывая, что лигандом являются молекулы аммиака NH3 . Назовите комплексное соединение.
Опыт 3. Образование гидроксокомплексов алюминия
С помощью обменной реакции получите осадок гидроксида алюминия. Разделите его на 2 пробирки. Исследуйте кислотно-основные свойства гидроксида алюминия, растворив осадок в первой пробирке в серной кислоте, а осадок во второй пробирке - в щелочи. Напишите уравнения реакций в молекулярном и ионном виде. Напишите названия полученных соединений. В полученном комплексном соединении к.ч. комплексообразователя равно 4.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Какое выражение соответствует константе нестойкости комплексного иона в соединении Na3[Co(NO2)6]?
1) 
| 4) 
|
2) 
| 5) 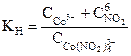
|
3) 
|
2. В каком соединении степень окисления комплексообразователя наименьшая?
| 1) [Cu(NH3)4]SO4 | 4) [Ag(NH3)2]Cl |
| 2) [Ni(NH3)6]Cl2 | 5) [Co(NH3)4]Cl2 |
| 3) [Hg(NH3)4](NO3)2 |
3. Чему равно координационное число комплексообразователя в соединении [Co(NH3)2(H2O)4]Cl3 ?
| 1) 9 | 2) 6 | 3) 2 | 4) 4 | 5) 7 |
4. Указать формулу гексацианоферрат (II) калия.
| 1) K3[Fe(CN)6] | 4) K2[Pt(CN)4] |
| 2) K4[Ni(CN)6] | 5) K4[Fe(CN)6] |
| 3) K3[Co(CN)6] |
5. Сравнив константы нестойкости, указать самый нестойкий ион.
1) 
| 4) 
|
2) 
| 5) 
|
3) 
|
| <== предыдущая лекция | | | следующая лекция ==> |
| A working definition of autonomy | | | A practical approach to learner autonomy |