
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Поняття про аудиторський ризик та його складові.
Дата добавления: 2015-09-19; просмотров: 457
|
|
Если диполи лежат на одной прямой, то очевидно (в первом приближении), что  . Для двух одинаковых молекул эта энергия будет -0.06 ккал/моль.
. Для двух одинаковых молекул эта энергия будет -0.06 ккал/моль.
Дисперсионное взаимодействие
Взаимодействие мгновенного диполя одной молекулы с наведенным им диполем другой молекулы. Это основной вид взаимодействия для неполярных молекул.
Формула Лондона: 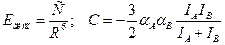 .
.
Для одинаковых молекул:  . Эти формулы строго применимы при R > 1.5R0, где R0 – сумма ван-дер-ваальсовых радиусов частиц. Если выражать Е [ккал/моль]; R– ангстремы, I - в эВ (1 эВ = 1.6´10-12 эрг), a- [A3/молекула], то
. Эти формулы строго применимы при R > 1.5R0, где R0 – сумма ван-дер-ваальсовых радиусов частиц. Если выражать Е [ккал/моль]; R– ангстремы, I - в эВ (1 эВ = 1.6´10-12 эрг), a- [A3/молекула], то  (3.10).
(3.10).
Для R= 5 А, aB= 10 A3/молекула, I = 10 эВ, получаем энергию порядка 1 ккал/моль.
Однако, полученная выше формула выведена для газовой фазы, в жидкости значения будут на 5-50% ниже. 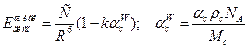 , где k – константа, равная 7.1, а
, где k – константа, равная 7.1, а  - поляризуемость растворителя в единичном объеме.
- поляризуемость растворителя в единичном объеме.
Донорно-акцепторные (Д-А) комплексы и водородная связь
Характерные величины энергии водородной связи – 3-8 ккал/моль, хотя в отдельных случаях она может достигать величин в 15 ккал/моль.
Механизм образования Д-А связи это частичный (полный) перенос одного или пары электронов от донора к акцептору. Сильная Д-А связь приводит к образованию так называемых КПЗ (комплексов с переносом заряда).
Характерные доноры: p-доноры (олефины, ацетиленовые углеводороды, ароматика) и n-доноры (гетероорганические соединения (O,N,S))
Характерные акцепторы: галогениды металлов (AlCl3, BF3, SnCl4), органические растворители с протонно-донорными группами, p-кислоты (соединения, содержащие вблизи двойной связи электроотрицательные группы).
Тема 4. Континуальные модели взаимодействия растворенной молекулы с растворителем
Сольватация ионов
Независимо от природы сил, обуславливающих процесс сольватации вещества, теплота растворения (DH0) должна являться алгебраической суммой энергии кристаллической решетки (DHреш, изменение энтальпии при удалении ионов в кристалле на бесконечность) и теплоты, выделившейся в результате сольватации катионов и анионов в растворе (DH#реш).

Где, DH0 - теплота растворения при бесконечном разбавлении. Естественно, что  >0,
>0,  < 0. DH0меняется от-40до+15ккал/моль.
< 0. DH0меняется от-40до+15ккал/моль.  берется из термодинамических таблиц, DH0- измеряется калориметрическим методом.
берется из термодинамических таблиц, DH0- измеряется калориметрическим методом.
Характерные величины 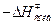 , ккал/моль.
, ккал/моль.
| Катион/анион | F | Cl | Br | I |
| Li | ||||
| Na | ||||
| K | ||||
| Rb | ||||
| Al |
Таким образом,  падает с ростом радиуса иона и растет с ростом заряда иона.
падает с ростом радиуса иона и растет с ростом заряда иона.
Модель Борна (сольватация иона радиусом a и зарядомz)
Борн предложил рассматривать ионы как жесткие проводящие шары и считать DGsolv как изменение энергии при переносе иона из вакуума в среду с диэлектрической проницаемостью. Ранее мы показали, что энергия тела, состоящего из совокупности зарядов  . Если тело – равномерно заряженная сфера или проводящий шар, то все
. Если тело – равномерно заряженная сфера или проводящий шар, то все  . Энергия такого тела в вакууме будет равна
. Энергия такого тела в вакууме будет равна  , в среде -
, в среде -  . Таким образом:
. Таким образом:  (для одного иона) или
(для одного иона) или 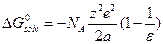 (на моль ионов).
(на моль ионов).
Это есть формула Борна (4.1).Оценим по нейэнергию сольватации однозарядного иона с радиусом 1.5 А в воде (e= 80)

Качественно и иногда полуколичественно формула Борна объясняет экспериментальные данные. При постоянных Р и Т мы можем написать  , т.е.
, т.е.  .
.

Уравнение Борна-Бьеррума (4.2)
Это уравнение уже можно использовать, т.к. 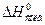 можно определить экспериментально.
можно определить экспериментально.
Недостатки модели Борна:
1) В эксперименте нет хорошей зависимости DGsolv от 1/e и z2/a.
2) Наблюдается завышенные значения DGsolv и DHsolv при использовании кристаллографических данных по величинам радиусов ионов.
| <== предыдущая лекция | | | следующая лекция ==> |
| Тема 3. Аудиторський ризик і оцінювання системи внутрішнього | | | Модель аудиторського ризику та використання її на практиці. |