
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Вивчення та оцінювання системи внутрішнього контролю.
Дата добавления: 2015-09-19; просмотров: 439
|
|
Стартуем с главного уравнения ТАК (10.1). Рассмотрим случай бимолекулярной реакции
Основное уравнение ТАК: А + B Û X ® продукты.
 , где
, где  - объем активации.
- объем активации.
По физическому смыслу объем активации есть разность парциальных мольных объемов комплекса и реагентов:  парциальный мольный объем реагента А [см3/моль].
парциальный мольный объем реагента А [см3/моль].  очевидно может быть и положительным, и отрицательным. Второй член -
очевидно может быть и положительным, и отрицательным. Второй член - 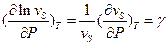 - изотермическая сжимаемость растворителя. Итого:
- изотермическая сжимаемость растворителя. Итого:
 (11.1)
(11.1)
Что есть объем активации? (обычно вторым членом пренебрегают ввиду малости). Экспериментально  определяют из зависимости lnkот давления по тангенсу угла наклона к кривой. Можно представить
определяют из зависимости lnkот давления по тангенсу угла наклона к кривой. Можно представить  в виде суммы:
в виде суммы:  , где:
, где:
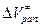 - изменение парциальных мольных объемов частиц
- изменение парциальных мольных объемов частиц
 - изменение парциального мольного объема растворителя
- изменение парциального мольного объема растворителя
 - изменение собственного объема растворителя за счет сольватации АК (в сольватной оболочке молекулы упакованы более плотно).
- изменение собственного объема растворителя за счет сольватации АК (в сольватной оболочке молекулы упакованы более плотно).
Если у нас неполярный АК образовался из неполярных частиц, то основной вклад дает 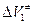
Если АК полярный и существенно отличается по полярности от исходных реагентов, то основной вклад дает  .
.
1) Пусть АК – неполярный. Если реакция мономолекулярная, то образование АК сопровождается удлинением разрываемой связи. Соответственно 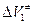 > 0 и константа скорости падает с ростом давления, что и наблюдается экспериментально.
> 0 и константа скорости падает с ростом давления, что и наблюдается экспериментально.
Бимолекулярная реакция – образуются новые связи, размеры АК меньше суммы размеров реагентов, соответственно 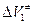 < 0 и константа скорости растет с ростом давления, что тоже наблюдается экспериментально.
< 0 и константа скорости растет с ростом давления, что тоже наблюдается экспериментально.
А что насчет  ? Здесь теория ничего не дает. Но наблюдаемая на опыте зависимость константы скорости от давления трактуется как уменьшение
? Здесь теория ничего не дает. Но наблюдаемая на опыте зависимость константы скорости от давления трактуется как уменьшение  с ростом давления.
с ростом давления. 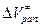 рассчитывается либо геометрически (исторический подход), либо квантово-химически.
рассчитывается либо геометрически (исторический подход), либо квантово-химически.
Рассмотрим теперь гетеролитические реакции (влияние  ):
):
Сольволиз tr-BuCl в 80% СН3ОН (SN1 - механизм)
(CH3)3C-Cl ¾k® (CH3)3C+ + Cl-
(CH3)3C+ + Cl- + CH3OH ¾® (CH3)3COH + CH3Cl
Реакция мономолекулярная, 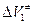 > 0, но константа скорости растет с ростом давления и
> 0, но константа скорости растет с ростом давления и 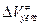 = -17 см3/моль при 1 атм. Объяснение – полярность переходного состояния (CH3)3Cd+¾Cld- , d ~ 0.7 – 0.9.
= -17 см3/моль при 1 атм. Объяснение – полярность переходного состояния (CH3)3Cd+¾Cld- , d ~ 0.7 – 0.9.
Так как фактически  - сольватационный член (
- сольватационный член (  ), то мы можем применить теоретический подход к оценке
), то мы можем применить теоретический подход к оценке  :
:  , для иона
, для иона  ,
, 
В случае диполя:  (11.2)
(11.2)
Вывод (11.2) 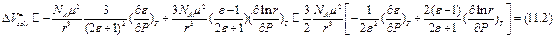
В рамках данной модели при учете только сольватации диполя и в пренебрежении изменения размеров частиц от давления можно получить:
 (11.3)
(11.3)
Для реакции: (C2H5)3N + (C2H5)I ® (C2H5)3Nd+…(C2H5)…Id- ® (C2H5)4N+ + I- расчет по формуле (11.3) дает  = 7.8 Дб, что близко к экспериментальному значению, полученному при изучении зависимости lnk от e.
= 7.8 Дб, что близко к экспериментальному значению, полученному при изучении зависимости lnk от e.
| <== предыдущая лекция | | | следующая лекция ==> |
| Помилка і шахрайство: визначення та фактори, що їх зумовлюють. | | | Комп’ютерне шахрайство: визначення та ознаки. |