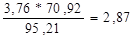Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Тема: Поняття про біосферу. Природні та антропогенні забруднення біосфери
Дата добавления: 2015-03-11; просмотров: 587
|
|
8. Вывод.
Лабораторная работа № 2
Тема: Свойства металлов и сплавов: углеродистые инструментальные стали.
Тип: применение и совершенствование знаний.
Цель: изучить технологический процесс плавления стали, получаемые сплавы и их свойства; уметь читать диаграмму состояния железоуглеродистых сплавов; рассмотреть свойства придаваемые сплавам легирующими элементами и «вредными» примесями.
Оснащение: учебник Макиенко Н. И. «Слесарное дело с основами материаловедения», тетрадь для лабораторно – практических работ, ручка, карандаш, линейка.
ХОД РАБОТЫ
1. Опишите технологический процесс получения углеродистой стали по конвекторному способу.
2. Каково устройство и работа мартеновской печи?
3. Каково назначение индукционной печи? Перечислите преимущества и недостатки индукционной печи.
4. Зарисовать диаграмму состояния железоуглеродистых сплавов по сталям (с.64, р.26 до 2% С).
5. Запишите состояние сплава и температуру его образования. Какими свойствами обладают образовавшиеся сплавы?
6. Назовите марки стали, которые используют для изготовления молотков, ножовочных полотен, напильников, ножниц?
7. Расшифруйте марки сталей: У10А, У8Г, У9ГА.
8. Вывод.
Лабораторная работа № 3
Тема: Свойства металлов и сплавов: углеродистые конструкционные стали.
Тип: применение и совершенствование знаний.
Цель: изучить устройство и работу электропечей, получаемые сплавы и их свойства; уметь читать диаграмму состояния железоуглеродистых сплавов и расшифровывать марки сталей; рассмотреть свойства придаваемые сплавам легирующими элементами и «вредными» примесями.
Оснащение: учебник Макиенко Н. И. «Слесарное дело с основами материаловедения», тетрадь для лабораторно – практических работ, ручка, карандаш, линейка.
ХОД РАБОТЫ
1. Каково устройство и работа электрической печи?
2. В чём заключается метод электрошлаковой переплавки?
3. Расшифруйте марки сталей: 10кп, 65Г, БСт6, ВКСт4, 0,8.
4. Опишите технологический процесс получения углеродистой стали по бессемеровскому ( томасовскому) способу.
5. Опишите классификацию сталей по группам А; Б; В.
6. Где применяются стали обыкновенного качества и качественные?
7. Вывод.
Лабораторная работа № 4
Тема: Твёрдые сплавы.
Тип: применение и совершенствование знаний.
Цель: изучить получаемые твёрдые сплавы их свойства и состав; уметь читать диаграмму состояния железоуглеродистых сплавов; рассмотреть сплавы получаемые спеканием и литые, соотнести свойства минерало- и металлокерамических сплавов.
Оснащение: учебник Макиенко Н. И. «Слесарное дело с основами материаловедения», тетрадь для лабораторно – практических работ, ручка, карандаш, линейка.
ХОД УРОКА
1. Дайте определение понятию «твёрдые сплавы».
2. Перечислите общие свойства твёрдых сплавов.
3. Для чего и с какой целью используют наплавочные твёрдые сплавы?
4. Дайте характеристику литым сплавам: стеллит и сормайт.
5. Дайте характеристику порошкообразным сплавам: вокар и сталинит.
6. Раскройте понятие «металлокерамические» твердые сплавы.
7. Расшифруйте марки твёрдых сплавов: ВК3; ВК3М; ВК4В; Т30К4; Т5К12В и область их применения.
8. Дайте характеристику минералокерамических сплавов. Область их применения.
9. Вывод.
Лабораторная работа № 5
Тема: Цветные металлы.
Тип: применение и совершенствование знаний.
Цель: изучить применяемые цветные металлы и их сплавы; свойства и состав; уметь читать диаграмму состояния железоуглеродистых сплавов; рассмотреть сплавы получаемые спеканием и литые.
Оснащение: учебник Макиенко Н. И. «Слесарное дело с основами материаловедения», тетрадь для лабораторно – практических работ, ручка, карандаш, линейка.
ХОД УРОКА
1. Перечислите общие свойства цветных металлов на примере меди и алюминия.
2. Каков состав латуни? Её свойства и применение в технике.
3. Расшифруйте марку: ЛС 59-1.
4. Каков состав бронзы? Её свойства и применение в технике.
5. Расшифруйте марку: БрОФ 6,5-0,25; БрОЦС 6-6-3.
6. Свойства дюралюминов. Их разновидности (деформируемые, высокопрочные, литейные).
7. Применение сплавов на основе алюминия и магния.
8. Применение сплавов на основе алюминия и меди.
9. Применение сплавов на основе алюминия и кремния.
10. Какие сплавы относятся к жаропрочным и их применение.
11. Перечислите свойства магниевых и титановых сплавов.
12. Достоинства и недостатки литейных магниевых сплавов.
13. Охарактеризуйте титановые сплавы.
14. Вывод.
Лабораторная работа № 6
Тема: Термическая обработка металла.
Тип: применение и совершенствование знаний.
Цель: изучить понятие «термическая обработка» металла; рассмотреть виды и технологию процесса, применение в производстве; воспитывать чувство ответственности за будущую профессию.
Оснащение: учебник Макиенко Н. И. «Слесарное дело с основами материаловедения» (68-80), тетрадь для лабораторно – практических работ, ручка, карандаш, линейка.
ХОД УРОКА
1. Дайте определение понятию «отжиг», каково его назначение?
2. Используя диаграмму «Оптимальные интервалы нагрева стали для отжига…» (с.68), заполните данные в таблицу № 1:
Таблица № 1
| № | наименование | назначение | Температура процесса | применение |
| Низкотемпературный | ||||
| Полный | ||||
| Неполный | ||||
| Изотермический | ||||
| Диффузионный | ||||
| Зернистый перлит | ||||
| Рекристаллизация | ||||
| Нормализация |
3. Дайте определение понятию «закалка», каково её назначение?
4. Перечислите виды закалочных сред.
5. Используя диаграмму «Оптимальные интервалы нагрева стали для отжига…» (с.68), заполните данные в таблицу № 2:
Таблица № 2
| № | Виды закалки | Технология | Применение | Температура процесса | Приобретаемые свойства | Достоинства и недостатки |
| В одном охладителе | ||||||
| В двух средах | ||||||
| Ступенчатая | ||||||
| С подстуживанием | ||||||
| Самоотпуском | ||||||
| Изотермическая | ||||||
| Патентирование |
6. Дайте характеристику поверхностной закалке заполнив таблицу № 3 данными:
Таблица № 3
| № | Виды поверхностной закалки | Оборудование | Температурный режим | Применение |
| Пламенная | ||||
| В электролите | ||||
| Токами высокой частоты |
7. Какова сущность обработки холодом?
8. Дайте определение понятию «отпуск», каково его назначение?
9. Опишите технологический процесс отпуска в таблице № 4:
Таблица № 4
| № | Низкий отпуск | Средний отпуск | Высокий отпуск |
10. В чём заключается сущность процесса старения стали?
11. Вывод.
Лабораторная работа № 7
Тема: Химико-термическая обработка стали.
Тип: применение и совершенствование знаний.
Цель: изучить понятие «химико-термическая» обработка стали, какие виды являются более распространенными, целесообразность их применения; рассмотреть технологию цементации, азотирования, цианирования и диффузной металлизации; воспитывать чувство ответственности за будущую профессию.
Оснащение: учебник Макиенко Н. И. «Слесарное дело с основами материаловедения» (81-86), тетрадь для лабораторно – практических работ, ручка, карандаш, линейка.
ХОД УРОКА
1. Дайте определение понятию «химико-термическая» обработка стали.
2. Дайте определение понятию «цементация», каково её назначение?
3. Что называют карбюризаторами?
4. Охарактеризуйте процесс цементации, заполнив таблицу № 1:
Таблица № 1
| № | Наименование | цементация | ||
| твёрдая | жидкая | газовая | ||
| Карбюризатор | ||||
| Технология процесса | ||||
| Материалы | ||||
| «+» «-» |
5. Дайте определение понятию «азотирование», каково её назначение?
6. Охарактеризуйте процесс азотирования, заполнив таблицу № 2:
Таблица № 2
| № | Наименование | Азотирование |
| Оборудование | ||
| Технология процесса | ||
| Глубина проникновения | ||
| Материалы |
7. Дайте определение понятию «цианирование»?
8. Охарактеризуйте процесс цианирования, заполнив таблицу № 3:
Таблица № 3
| № | наименование | цианирование | ||||
| твёрдое | жидкое | Высоко температурное | Средне температурное | Низко температурное | ||
| Карбюризатор | ||||||
| Приобретаемые свойства | ||||||
| Материалы |
9. Раскройте сущность процесса нитроцементации.
10. Дайте определение понятию «диффузная металлизация», каково её назначение?
11. Охарактеризуйте процесс алитирования, заполнив таблицу № 4:
Таблица №4
| № | наименование | алитирование | ||
| твёрдое | жидкостное | металлизация | ||
| Технология процесса |
12. Охарактеризуйте процесс хромирования, заполнив таблицу № 5:
Таблица № 5
| № | наименование | хромирование | ||
| твёрдое | жидкостное | газовое | ||
| Технология процесса |
13. Вывод.
Лабораторная работа № 8
Тема: Неметаллы. Абразивы. Жидкости.
Тип: применение и совершенствование знаний.
Цель: изучить
Оснащение: учебник Макиенко Н. И. «Слесарное дело с основами материаловедения», тетрадь для лабораторно – практических работ, ручка, карандаш, линейка.
ХОД УРОКА
1. Дайте определение понятию «пластические массы» и опишите их общие свойства.
2. Дайте определение понятию «полимеры».
3. Из перечисленных видов пластмасс выберите те, которые соответствуют свойствам, указанным в таблице № 1.
Пластмассы: фенопласты, аминопласты, полиэфирные, эпоксидные и полиамидные смолы, текстолит, поделочный и электротехнический текстолит, гетинакс, стеклотекстолит, органическое стекло, асбестотекстолит, капрон, нейлон, пенопласт, целлулоид, винипласт.
Таблица № 1
| № | Свойства | Пластические массы |
| Способность к окрашиванию | ||
| Способность к повторной формовке | ||
| Эластичность | ||
| Устойчивость к коррозии | ||
| Устойчивость к воздействию кислот | ||
| Электропроводность | ||
| Температурная стойкость | ||
| Способность к склеиванию | ||
| Износоустойчивость | ||
| Хорошее отношение к резанию | ||
| Хорошее сопротивление трению | ||
| Высокая прочность на разрыв | ||
| Низкая гигроскопичность | ||
| Вязкость при низких температурах | ||
| Высокие изоляционные показатели | ||
| Низкая способность к горению | ||
| Высокая способность к горению |
4. Сообщите основные свойства и состав, которыми обладают материалы и результаты внесите в таблицу № 2:
Таблица № 2
| № | Материалы | Свойства | Состав | |
| Резина | ||||
| Эбонит | ||||
| Водонепроницаемый картон | ||||
| Электроизоляционный картон | ||||
| Слюда | ||||
| Асбест | ||||
| Фибра | ||||
| Паронит | ||||
| Кожа техническая | ||||
| Войлок технический | ||||
5. Дайте характеристику абразивам и результаты занесите в таблицу № 3:
Таблица № 3
| Абразивы | |||
| природные | искусственные | ||
| наименование | характеристика | наименование | характеристика |
| Алмаз | Электрокорунд нормальный | ||
| Корунд | Электрокорунд белый | ||
| Наждак | Карбид кремния | ||
| Кварц | Карбид бора | ||
| Гранат | Борсиликокарбид | ||
| Синтетический алмаз |
6. Опишите классификацию отечественных масел.
7. Вывод.
ПЕРЕЧЕНЬ ВАРИАНТОВ ДЛЯ РАСЧЕТНОЙ РАБОТЫ
Вариант №1
| Вещество | Состав, % по массе | ||||
| MgCL2 | KCL | NaCL | MgO | Mg | |
| Безводный карналлит | 48.5 | 42.3 | 5.8 | 3.4 | - |
| Отработанный электролит | 4,6 | 73,0 | 22,12 | 0,28 | - |
| Шлам | 33,5 | 3,5 | |||
| Возгон | 31,6 | 25,4 | - | - | |
| Магний-сырец | 0,02 | 0,19 | 0,09 | - | 99,7 |
Вариант №2
| Вещество | Состав, % по массе | ||||
| MgCL2 | KCL | NaCL | MgO | Mg | |
| Безводный карналлит | - | ||||
| Отработанный электролит | 4,5 | 19,3 | 0,2 | - | |
| Шлам | |||||
| Возгон | - | - | |||
| Магний-сырец | 0,01 | 0,26 | 0,15 | - | 99,58 |
Вариант №3
| Вещество | Состав, % по массе | ||||
| MgCL2 | KCL | NaCL | MgO | Mg | |
| Безводный карналлит | - | ||||
| Отработанный электролит | 4,2 | 77,2 | 18,4 | 0,2 | - |
| Шлам | 8,5 | 15,5 | |||
| Возгон | - | - | |||
| Магний-сырец | 0,03 | 0,3 | 0,2 | - | 99,47 |
Вариант №4
| Вещество | Состав, % по массе | ||||
| MgCL2 | KCL | NaCL | MgO | Mg | |
| Безводный карналлит | - | ||||
| Отработанный электролит | 5,3 | 14,5 | 0,2 | - | |
| Шлам | |||||
| Возгон | - | - | |||
| Магний-сырец | 0,01 | 0,3 | 0,09 | - | 99,6 |
Вариант №5
| Вещество | Состав, % по массе | ||||
| MgCL2 | KCL | NaCL | MgO | Mg | |
| Безводный карналлит | - | ||||
| Отработанный электролит | 4,5 | 18,4 | 0,1 | - | |
| Шлам | |||||
| Возгон | - | - | |||
| Магний-сырец | 0,02 | 0,15 | 0,43 | - | 99,4 |
Вариант №6
| Вещество | Состав, % по массе | ||||
| MgCL2 | KCL | NaCL | MgO | Mg | |
| Безводный карналлит | 51,0 | 42,0 | 6,0 | 1,0 | - |
| Отработанный электролит | 5,0 | 75,0 | 19,8 | 0,2 | - |
| Шлам | 8,0 | 54,0 | 15,0 | 20,0 | 3,0 |
| Возгон | 30,0 | 40,0 | 30,0 | - | |
| Магний-сырец | 0,02 | 0,28 | 0,10 | - | 99,6 |
Пример расчета.
Введение
При расчете магниевых электролизеров используются показатели промышленных данных. Ниже приведен пример расчета диафрагменного электролизера на 100 кА с верхним вводом анодов для электролиза безводного карналлита.
Исходные данные:
Таблица 1.1.
| № | Параметры | Ед. изм | Значения |
| 1. | Сила тока | кА | |
| 2. | Плотность тока | А/см2 | |
| Анодная Да | 0,41 | ||
| Катодная Дк | 0,50 | ||
| Проходная плотность тока в аноде в аноде Да/ | 5,2 | ||
| Проходная плотность тока в катоде Дк/ | |||
| 3. | Расстояние между электродами | см | |
| 4. | Ширина анода Ва | см | |
| 5. | Выход по току | % | |
| 6. | Выход на 1кг магния-сырца | кг | |
| Шлама | 0,12 | ||
| Возгона | 0,1 | ||
| Отработанного электролита | 3,8 | ||
| 7. | Отсос газа из катодных ячеек | М3/ч |
Состав нагруженного в электролизер сырья и извлекаемых из него веществ:
Вариант №0 Таблица 1.2.
| Вещество | Состав, % по массе | ||||
| MgCL2 | KCL | NaCL | MgO | Mg | |
| Безводный карналлит | 51,0 | 42,0 | 6,0 | 1,0 | - |
| Отработанный электролит | 5,0 | 75,0 | 19,8 | 0,2 | - |
| Шлам | 8,0 | 54,0 | 15,0 | 20,0 | 3,0 |
| Возгон | 30,0 | 40,0 | 30,0 | - | - |
| Магний-сырец | 0,02 | 0,28 | 0,10 | - | 99,6 |
ВАРИАНТЫ ДЛЯ РАСЧЕТА
| Вариант | I,кА | Да, А/см | Дк, А/см2 | Да, А/см2 | Дк, А/см2 | Nn Mg % | Nn CI% | Шлам, кг | Возгон кг | Отр. электролит, кг |
| 0,4 | 0,52 | 5,1 | 25,6 | 0,15 | 0,1 | 3,9 | ||||
| 0,41 | 0,51 | 5,0 | 24,0 | 0,12 | 0,2 | |||||
| 0,42 | 0,50 | 4,7 | 24,3 | 0,14 | 0,3 | 3,92 | ||||
| 0,43 | 0,53 | 4,8 | 25,1 | 0,11 | 0,15 | 3,8 | ||||
| 0,39 | 0,50 | 5,2 | 23,7 | 0,15 | 0,25 | 3,85 | ||||
| 0,38 | 0,48 | 4,9 | 25,8 | 0,12 | 0,2 | |||||
| 0,37 | 0,43 | 5,2 | 25,2 | 0,13 | 0,3 | 3,95 | ||||
| 0,39 | 0,52 | 4,8 | 24,5 | 0,12 | 0,12 | 3,9 | ||||
| 0,42 | 0,49 | 4,7 | 24,8 | 0,15 | 0,1 | 3,9 | ||||
| 0,40 | 0,47 | 5,0 | 24,9 | 0,12 | 0,2 | 3,93 | ||||
| 0,38 | 0,49 | 5,1 | 24,5 | 0,14 | 0,3 | 3,95 | ||||
| 0,41 | 0,51 | 4,8 | 25,5 | 0,11 | 0,15 | |||||
| 0,37 | 0,50 | 5,1 | 24,4 | 0,15 | 0,25 | 3,85 | ||||
| 0,42 | 0,53 | 4,7 | 25,6 | 0,12 | 0,2 | |||||
| 0,43 | 0,52 | 5,2 | 24,3 | 0,13 | 0,3 | 3,85 | ||||
| 0,39 | 0,48 | 4,9 | 25,8 | 0,12 | 0,12 | 3,87 | ||||
| 0,41 | 0,49 | 4,8 | 25,3 | 0,15 | 0,1 | 3,9 | ||||
| 0,37 | 0,48 | 5,0 | 24,1 | 0,12 | 0,2 | |||||
| 0,38 | 0,50 | 5,1 | 23,8 | 0,14 | 0,3 | 3,92 | ||||
| 0,37 | 0,52 | 5,2 | 25,5 | 0,11 | 0,15 | 3,94 | ||||
| 0,42 | 0,54 | 4,9 | 24,9 | 0,15 | 0,25 | 3,96 | ||||
| 0,40 | 0,53 | 4,7 | 24,1 | 0,12 | 0,3 | 3,99 | ||||
| 0,43 | 0,51 | 4,8 | 25,0 | 0,13 | 0,12 | 3,8 | ||||
| 0,39 | 0,49 | 4,7 | 25,3 | 0,12 | 0,1 | |||||
| 0,50 | 5,0 | 24,9 | 0,13 | 0,2 | 3,85 | |||||
| ПРИМЕР РАСЧЕТА МАГНИЕВОГО ЭЛЕКТРОЛИЗЕРА | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Материальный баланс
1.В расчет материального баланса входит определение количеств исходного сырья и продуктов, полученных в результате процесса электролиза.
Производительность электролизера определяем согласна закону Фарадея:
P=0.454*I*nt
P- производительность электролизера (кг/ч)
) I-сила тока (А)
nt-выход тока, (доли единиц)
0,454-электрохимический эквивалент магния, (г/А*ч)
При электролизе за час работы электролизера выделяется магния:
1.В состав магния-сырца:
P=0,454*100*0,8=36,3 кг/ч
2.В состав шлама:
36,3*0,12*0,03=0,13 кг/ч
Где 0,12-выход шлама (таблица 1.1)
0,03-содержания магния (таблица 1.2)
Всего: 36,3+0,13=36,43 кг/ч
Извлекается из электролизера (кг/ч):
Магний-сырца 36,43:0,996=36,5 кг
Где 0,996-содержание магния в магнии-сырце, (доли единиц)(таблица 1.2.)
Шлама 36,5*0,12=4,38
Где 0,12-выход шлама (кг) (таблица 1.1.)
Возгона 36,5*0,10=3,65 кг
Где 0,10-выход возгона (кг) (таблица 1.1)
Отработанного электролита 36,5*3,8=138,7
Где 3,8-выход отработанного электролита (кг) (таблица 1.1.)
Хлора 100*1,323*0,8=105,84
Где 100-сила тока (кА)
1,323-электрохимический эквивалент хлора (г/А*ч)
0,8-выход по току, (доли единиц)
Часовой расход безводного карналлита составляет:
36,5+4,38+3,65+138,7+105,84=289 кг
Расход безводного карналлита (51% MgCI2) на 1кг магния-сырца:
289KCI*MgCI2 36.5 Mg
Х кг 1 кг
289*1/36,5=7,93 кг
Результаты расчета сведены в таблицу.2
Материальный баланс магниевого электролизера на 100 кА
Наряду с основными процессами происходит ряд побочных.
Например: в карналлитовом электролите частично хлорируется оксид магния. За 1 час в электролизере поступает оксид магния в составе безводного карналлита.
289*0,01=2,89 кг
Где 0,01-содержания MgO в безводном карналлите, (доли единиц).(Таблица 1.2.) За это же время из электролиза извлекаются оксид магния (в составе отработанного электролита и шлама) (Таблица 2 и таблица 1.2.) 138,7*0,002+4,38*0,2=1,25 кг
При хлорирование MgO расходуется некоторое количество хлора, что уменьшает его выход, и образуется дополнительное количество хлорида магния, используемого для электролиза. Степень хлорирования оксида магния:
При хлорировании оксида магния получается хлорида магния: (2,89-1,25)*2,36=3,76 кг/ч
Где 2,36-отношение молекулярных масс MgCI2 и МдО
Расходуется хлора:
Где 70,92 и 95,21-соответсвенно молекулярные массы хлора и хлорида магния | Материальный баланс
1.В расчет материального баланса входит определение количеств исходного сырья и продуктов, полученных в результате процесса электролиза.
Производительность электролизера определяем согласна закону Фарадея:
P=0.454*I*nt
P- производительность электролизера (кг/ч)
) I-сила тока (А)
nt-выход тока, (доли единиц
0,454-электрохимический эквивалент магния, (г/А*ч)
При электролизе за час работы электролизера выделяется магния:
1.В состав магния-сырца:
P=
2.В состав шлама:
= кг/ч
Всего:
Извлекается из электролизера (кг/ч):
Магний-сырца
Шлама
Возгона
Отработанного электролита
Хлора
Часовой расход безводного карналлита составляет:
Расход безводного карналлита (51% MgCI2) на 1кг магния-сырца:
KCI*MgCI2 Mg
Х кг 1 кг
Результаты расчета сведены в таблицу.2
Материальный баланс магниевого электролизера на кА
Наряду с основными процессами происходит ряд побочных.
В карналлитовом электролите частично хлорируется оксид магния.
За 1 час в электролизере поступает оксид магния в составе безводного карналлита.
= кг
За это же время из электролиза извлекаются оксид магния (в составе отработанного электролита и шлама):
При хлорирование MgO расходуется некоторое количество хлора, что уменьшает его выход, и образуется дополнительное количество хлорида магния, используемого для электролиза. Степень хлорирования оксида магния:
При хлорировании оксида магния получается хлорида магния:
Расходуется хлора:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.Конструктивный расчет.
А) расчет анодов.
Площадь поверхности сечения всех анодов ровна
S= I: Дa/
Где S-площадь поперечного сечения, см2
I-сила тока, (А)
Дa! а-проходная плотность в аноде (А/см2)
S=100000/5.2=19250 cм2
Для изготовления анодов применяем графитовые брусья поперечным сечением 20х30 см.
Определим расчетное число брусьев во всех анодах:
 Принимаем 5 анодов по 7 брусьев в каждом.
Фактическая плотность тока в аноде
Принимаем 5 анодов по 7 брусьев в каждом.
Фактическая плотность тока в аноде
 Что соответствует принятой плотности тока.
Принимая рабочую высоту анода На=90 см, определим величину рабочей поверхности анода:
Sa=Ha*Ba
Где Ва- ширина анода, (см) (20*7=210)
Sa=90*210=18900 см2
Б) Расчет Катодов
Величина рабочей поверхности катода определяется соотношением анода и катодной плотностей тока:
Что соответствует принятой плотности тока.
Принимая рабочую высоту анода На=90 см, определим величину рабочей поверхности анода:
Sa=Ha*Ba
Где Ва- ширина анода, (см) (20*7=210)
Sa=90*210=18900 см2
Б) Расчет Катодов
Величина рабочей поверхности катода определяется соотношением анода и катодной плотностей тока:
 Где Да-анодная плотность тока, (А/см2)
Дк- катодная плотность тока, (А/см2)
Где Да-анодная плотность тока, (А/см2)
Дк- катодная плотность тока, (А/см2)
 Найдем высоту катодного листа, учитывая. что ширина катода равна ширине анода:
Нк=15500/210 =74 см
Число катодов больше в два раза числа анодов по особенности конструкции: 5*2=10
Найдем высоту катодного листа, учитывая. что ширина катода равна ширине анода:
Нк=15500/210 =74 см
Число катодов больше в два раза числа анодов по особенности конструкции: 5*2=10
| 2.Конструктивный расчет.
А) расчет анодов.
Площадь поверхности сечения всех анодов ровна
S= I: Дa/
Где S-площадь поперечного сечения, см2
I-сила тока, (А)
Дa! а-проходная плотность в аноде (А/см2)
S=
Для изготовления анодов применяем графитовые брусья поперечным сечением 20х30 см.
Определим расчетное число брусьев во всех анодах:
m=
Фактическая плотность тока в аноде
Да =
Принимая рабочую высоту анода На= см, определим величину рабочей поверхности анода:
Sa=Ha*Ba
Sa=
Б) Расчет Катодов
Величина рабочей поверхности катода определяется соотношением анода и катодной плотностей тока:
 Где Да-анодная плотность тока, (А/см2)
Дк- катодная плотность тока, (А/см2)
sk=
Найдем высоту катодного листа, учитывая, что ширина катода равна ширине анода:
Нк=
Число катодов больше в два раза числа анодов по особенности конструкции:
Где Да-анодная плотность тока, (А/см2)
Дк- катодная плотность тока, (А/см2)
sk=
Найдем высоту катодного листа, учитывая, что ширина катода равна ширине анода:
Нк=
Число катодов больше в два раза числа анодов по особенности конструкции:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.Расчет напряжения.
Баланс напряжения электролизера определяется равенством: (В)
U=Va+Vk+Vэ+Vош+Е
Где U-напряжения электролизера,
Va-перепад напряжения в аноде
Vk- перепад напряжения в катоде
Vэ-перепад напряжения в электролите
Vош- перепад напряжения в ошиновке
Е-напряжения разложения
Перепад напряжения в аноде:
Va=Д!а*Lа*pгр
Где Д /а- проходная плотность тока в аноде ,(А/см2)
Lа- путь тока по аноду, Lа=140 см
pгр- удельное сопротивление искусственного графита,11,5х10-4 Ом*см
Va=4,76х140х11,5х10-4=0,77 В
Перепад напряжения в катоде:
Vk=Дk*lk*pст
Где Дk-проходная плотность тока в катоде
lk- пусть тока по катоду,170 см
pст –удельное сопротивление стали при 5000 С ,(0,6*10-4 Ом*см)
Vk=25*170*0.6*10-4=0.26 B
Перепад напряжения в электролите вычисляем по формуле
V=Д ср*L
 K*k
Где Д ср= K*k
Где Д ср=  –плотность тока в среднем сечении электролита, (А/см2)
L-расстояние между электродами, (см) (Таблица 1.1.)
K-удельная электропроводимость электролита, К=1,83 0м-1 *см-1
K=коэффициент уменьшения электропроводимости электролита в следствии газонаполнения, К=0,93 –плотность тока в среднем сечении электролита, (А/см2)
L-расстояние между электродами, (см) (Таблица 1.1.)
K-удельная электропроводимость электролита, К=1,83 0м-1 *см-1
K=коэффициент уменьшения электропроводимости электролита в следствии газонаполнения, К=0,93
  Падение напряжения в ошиновке Vош принимаем. Согласно практическим данным=0,3В
Напряжение разложения Е=2,8В
Напряжения на зажимах электролизеров.
U=0.77+0.26+1.85+0.3+2.8= 5,98 B
Падение напряжения в ошиновке Vош принимаем. Согласно практическим данным=0,3В
Напряжение разложения Е=2,8В
Напряжения на зажимах электролизеров.
U=0.77+0.26+1.85+0.3+2.8= 5,98 B
| 3.Расчет напряжения.
Баланс напряжения электролизера определяется равенством:
U=Va+Vk+Vэ+Vош+Е
Где U-напряжения электролизера, (В)
Va-перепад напряжения в аноде (В)
Vk- перепад напряжения в катоде (В)
Vэ-перепад напряжения в электролите
Vош- перепад напряжения в ошиновке
Е-напряжения разложения
Перепад напряжения в аноде:
Va=Д!а*Lа*pгр
Где Д /а- проходная плотность тока в аноде ,(А/см2)
Lа- путь тока по аноду, Lа=140 см
pгр- удельное сопротивление искусственного графита,11,5х10-4 Ом*см
Va=
Перепад напряжения в катоде:
Vk=Дk*lk*pст
Где Дk-проходная плотность тока в катоде
lk- пусть тока по катоду,170 см
pст –удельное сопротивление стали при 5000 С ,(0,6*10-4 Ом*см)
Vk=
Перепад напряжения в электролите вычисляем по формуле
V=Д ср*L
 K*k
Где Д ср= K*k
Где Д ср=  –плотность тока в среднем сечении электролита, (А/см2)
L-расстояние между электродами, (см) (Таблица 1.1.)
K-удельная электропроводимость электролита, К=1,83 0м-1 *см-1
K=коэффициент уменьшения электропроводимости электролита в следствии газонаполнения, К=0,93
V=
Падение напряжения в ошиновке Vош принимаем. Согласно практическим данным=0,3В
Напряжение разложения Е=2,8В
Напряжения на зажимах электролизеров
.
U= –плотность тока в среднем сечении электролита, (А/см2)
L-расстояние между электродами, (см) (Таблица 1.1.)
K-удельная электропроводимость электролита, К=1,83 0м-1 *см-1
K=коэффициент уменьшения электропроводимости электролита в следствии газонаполнения, К=0,93
V=
Падение напряжения в ошиновке Vош принимаем. Согласно практическим данным=0,3В
Напряжение разложения Е=2,8В
Напряжения на зажимах электролизеров
.
U=
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4.Тепловой расчет.
Тепловой расчет заключается в составлении теплового равновесия, т.е
Qприхода = Qрасхода
Расчет ведем, принимая температуру процесса 7000 С по уравниванию:
I*V*860=Qр+Qн +Qи+Qпр+Qко +Qтп
Где I-сила тока.(кА)
V- перепад напряжения между электродами, (В)
Qр+Qн +Qи+Qпр – соответственно расход тепла на разложение хлористого магния, нагревание загруженных веществ, испарение электролита и разложение примесей, (ккал/час)
Qко +Qтп– соответственно тепловые потери с газами катодного отсоса из поверхности электролизера, (ккал/час)
А) Приходная часть баланса.
Приход тепла от подведенной электроэнергии
N= 860*I*Vа.к
Va.k =U - Vони
Va.k =5,98-0,3=5,68В
N=100*5.68*860=488480 ккал/ч
Б)Расходная часть баланса.
1.Расход тепла на разложение хлорида магния:
Qp=a md*(H700+H700/)-ax*cx (tэ-tх)
Где - a md количество получаемого в составе магния-сырца и шлама маталлического магния, (кг\ч)
Ах – количество хлора, (кг/ч) (таблица 2.)
H700-удельная теплота образования MgCI2 при 7000C отнесенная к 1кг магния (ккал\кг)
Н700/ -удельная теплота образования KCl*MgCl2 ghb 7000C
CX – теплоемкость хлора, (ккал/кг град)
(tэ-tх)-соответственно температуры хлора в момент выделения и на выходе (С)
Qp= 36.43*(5866+331)-105.84*0.1276*(700-300)=213491 ккал/ч
2.расход тепла на нагревание загруженного безводного карналлита.
Qh=ak*ck (tэ-tк)
Где а- количество загружаемого безводного карналлита, (кг\ч) (таблица 2)
ck- удельная теплоемкость жидкого безводного карналлита, (ккал/кг.град)
(tэ-tк)- соответственно температура электролита и безводного карналлита.(С0)
QH=289*0.266(700-680)=1537 ккал/ч
3.Расход тепла на испарение электролита.
Qu=∑Bqu
Где В-количество соли в возгоне ,(кг/ч)
qu- теплота испарения соли,(ккал/ч)
Согласно материальному балансу, за 1 час получается 3,65 кг возгона, в том числе 1,10 кг MgCI2 1.46 кг KCI и 1.10 NACI (таблица 1.2.)
Qпр= 1.10*344+1.46*530+110*702=1924 ккал/ч
4.Расход тепла на разложение примесей.
Согласно практическим данным, расход тепла по этой статье составляет в среднем 14,5 ккал на 1 кг безводного карналлита.
Qпр=289*14,5=4191 ккал/ч
5.Потери тепла с воздухом, отсасываемым из катодного пространства,(м/ч)
Qk.o=aв*cв(tг-tв)
Где ав - количество воздуха, отсасываемого из катодного пространства (м3 /ч)
Cв - теплоемкость воздуха, (ккал/м3 град)
(tв-tг) - соотвественно температура воздуха на входе в электролизер и на выходе из него, С0
Qk.o=1220*0,31(270-20)=93000 ккал/ч
6.Потери тепла с поверхности электролизера:
Qт.п =N-∑Q
Qт.п=488480-(213491+1537+1924+4191+93000)=174337 ккал/ч
Результаты расчета сводим в таблицу
| 4.Тепловой расчет.
Тепловой расчет заключается в составлении теплового равновесия, т.е
Qприхода = Qрасхода
Расчет ведем, принимая температуру процесса 0 С по уравниванию:
I*V*860= Qр+Qн +Qи+Qпр+Qко +Qтп
Где I-сила тока.(кА)
V- перепад напряжения между электродами, (В)
Qр+Qн +Qи+Qпр – соответственно расход тепла на разложение хлористого магния, нагревание загруженных веществ, испарение электролита и разложение примесей, (ккал/час)
Qко +Qтп– соответственно тепловые потери с газами катодного отсоса из поверхности электролизера, (ккал/час)
А) Приходная часть баланса.
Приход тепла от подведенной электроэнергии
N=
Va.k =U - Vони
Va.k =
N=
Б)Расходная часть баланса.
1.Расход тепла на разложение хлорида магния:
Qp=a md*(H700+H700/)-ax*cx (tэ-tх)
Где - a md количество получаемого в составе магния-сырца и шлама маталлического магния, (кг\ч)
Ах – количество хлора, (кг/ч) (таблица 2.)
H700-удельная теплота образования MgCI2 при 7000C отнесенная к 1кг магния (ккал\кг)
Н700/ -удельная теплота образования KCl*MgCl2 ghb 7000C
CX – теплоемкость хлора, (ккал/кг град)
(tэ-tх)-соответственно температуры хлора в момент выделения и на выходе (С)
Qp=
2.расход тепла на нагревание загруженного безводного карналлита.
Qh=ak*ck (t-t)
Где а- количество загружаемого безводного карналлита, (кг\ч) (таблица 2)
ck- удельная теплоемкость жидкого безводного карналлита, (ккал/кг.град)
(t-t)- соответственно температура электролита и безводного карналлита.(С0)
Qh=
3.Расход тепла на испарение электролита.
Qu=∑Bqu
Где В-количество соли в возгоне ,(кг/ч)
Q- теплота испарения соли,(ккал/ч)
Согласно материальному балансу, за 1 час получается кг возгона, в том числе кг MgCI2 кг KCI и кг NACI
Qпр=
4.Расход тепла на разложение примесей.
Согласно практическим данным, расход тепла по этой статье составляет в среднем 14,5 ккал на 1 кг безводного карналлита.
Qпр=
5.Потери тепла с воздухом, отсасываемым из катодного пространства,(м/ч)
Qk.o=aв*cв(tг-tв)
Где ав - количество воздуха, отсасываемого из катодного пространства (м3 /ч)
Cв - теплоемкость воздуха, (ккал/м3 град)
(tв-tг) - соотвественно температура воздуха на входе в электролизер и на выходе из него, С0
Qk.o=
6.Потери тепла с поверхности электролизера:
Qт.п =N-EQ
Qт.п=
Результаты расчета сводим в таблицу
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
5.Расчет показателей процесса электролиза.
Выход по энергии рассчитывают по формуле:
 Где ήэн - выход по энергии(%)
U- напряжение на электролизере (В)
ήт - выход по току.(доли единиц)
Выход энергии без учета потери энергии в ошиновке:
ήэн=3.1/5,68 *0.8*100=43.5%
С учетом потери энергии в ошиновке
ήэн =3.1/5,98 *0.8*100=41,5%
Удельный расход электрической энергии на зажимах электролизера.
Согласно формуле равен:
Wy=5.98/0,454*0.8=16.5 кВт ч./кг
Выход магния на 1 кВт. Ч затраченной электроэнергии
Amd =1000/16,5 *0.996=60.3 г
Где ήэн - выход по энергии(%)
U- напряжение на электролизере (В)
ήт - выход по току.(доли единиц)
Выход энергии без учета потери энергии в ошиновке:
ήэн=3.1/5,68 *0.8*100=43.5%
С учетом потери энергии в ошиновке
ήэн =3.1/5,98 *0.8*100=41,5%
Удельный расход электрической энергии на зажимах электролизера.
Согласно формуле равен:
Wy=5.98/0,454*0.8=16.5 кВт ч./кг
Выход магния на 1 кВт. Ч затраченной электроэнергии
Amd =1000/16,5 *0.996=60.3 г
| 5.Расчет показателей процесса электролиза.
Выход по энергии рассчитывают по формуле:
 Где ήэн - выход по энергии(%)
U- напряжение на электролизере (В)
ήт - выход по току.(доли единиц)
Выход энергии без учета потери энергии в ошиновке:
ήэн =
С учетом потери энергии в ошиновке
ήэн =
Удельный расход электрической энергии на зажимах электролизера.
Согласно формуле равен:
Wy=
Выход магния на 1 кВт. Ч затраченной электроэнергии
Amd =
Где ήэн - выход по энергии(%)
U- напряжение на электролизере (В)
ήт - выход по току.(доли единиц)
Выход энергии без учета потери энергии в ошиновке:
ήэн =
С учетом потери энергии в ошиновке
ήэн =
Удельный расход электрической энергии на зажимах электролизера.
Согласно формуле равен:
Wy=
Выход магния на 1 кВт. Ч затраченной электроэнергии
Amd =
|
Министерство образования и науки Красноярского края
КГБОУ СПО «Красноярский индустриально-металлургический техникум»
Министерство образования и науки Красноярского края
КГБОУ СПО «Красноярский индустриально-металлургический техникум»
| <== предыдущая лекция | | | следующая лекция ==> |
| Лекція 2 | | | Властивості живої речовини біосфери |