Тема: Периодический закон и периодическая система Д.И. Менделеева в свете теории строения атома. Классификация неорганических соединений. Химическая связь и строение веществпо дисциплине «Физическая и коллоидная химия» 1. Законы идеальных газов. 2. Молекулярно-кинетическая теория газов. 3. Реальные газы. 4. Основные понятия химической термодинамики. 5. Первый закон термодинамики. 6. Энтальпия. 7. Термохимия. Закон Гесса. 8. Уравнение Кирхгофа. 9. Обратимые и необратимые процессы. 10. Второй закон термодинамики. 11. Энтропия. 12. Энергия Гиббса. Критерий самопроизвольного протекания реакции. 13. Энергия Гельмгольца. 14. Уравнение изотермы химической реакции. Химическое сродство. 15. Основные определения фазовых равновесий. Правило фаз Гиббса. 16. Однокомпонентные системы. 17. Уравнение Клаузиуса-Клапейрона. 18. Жидкие бинарные системы. Закон Рауля. 19. Эбуллиоскопия. 20. Криоскопия. 21. Системы с ограниченной растворимостью в жидкой фазе. 22. Закон распределения. Экстракция. 23. Растворы электролитов. Теория электролитической диссоциации. 24. Сильные и слабые электролиты. 25. Электропроводность растворов электролитов. 26. Скачок потенциала на границе фаз. 27. Токообразующие реакции. 28. Уравнение Нернста. Термодинамика токообразующих реакций. 29. Электродные потенциалы. 30. Классификация электродов. 31. Электролиз. 32. Электрохимическая коррозия. 33. Скорость химической реакции. 34. Молекулярность и порядок химической реакции. 35. Методы определения порядка реакции. 36. Уравнение Вант-Гоффа. 37. Теория активных столкновений. 38. Теория переходного состояния. 39. Основные понятия механизма химической реакции. 40. Одностадийные и сложные реакции. 41. Конкурирующие реакции. 42. Последовательные реакции. 43. Цепные реакции. 44. Фотохимические реакции. 45. Основные понятия катализа. 46. Общие закономерности катализа. 47. Гомогенный катализ. 48. Гетерогенный и ферментативный катализ. 49. Предмет и задачи коллоидной химии. Дисперсные системы. 50. Классификация дисперсных систем. 51. Природа поверхностной энергии. 52. Адсорбция. Количественные характеристики. 53. Классификация процессов адсорбции. 54. Адсорбция газов и паров на поверхности твердых тел. 55. Коллоидные растворы. Строение коллоидных частиц. 56. Броуновское движение. Диффузия. 57. Электрокинетические явления в гидрофобных золях. 58. Пути образования двойного электрического слоя. 59. Строение двойного электрического слоя. 60. Факторы, влияющие на дзета-потенциал. 61. Седиментационная устойчивость дисперсных систем. 62. Агрегативная устойчивость дисперсных систем. Коагуляция.
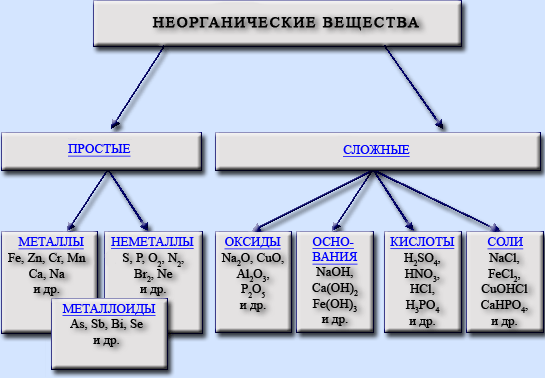
Лекция № 1 Тема: Периодический закон и периодическая система Д.И. Менделеева в свете теории строения атома. Классификация неорганических соединений. Химическая связь и строение веществ. Периодический закон Д. И. Менделеева и периодическая система элементов Периодический закон Д. И. Менделеева и его обоснование с точки зрения электронного строения атомов. Открытие периодического закона и разработка периодической системы химических элементов Д. И. Менделеевым явились вершиной развития химии в XIX в. Обширная сумма знаний о свойствах 63 элементов, известных к тому времени, была приведена в стройный порядок. Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869 г. впервые сформулировал периодический закон: Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. Несмотря на всю огромную значимость такого открытия, периодический закон и система Менделеева представляли лишь гениальное эмпирическое обобщение фактов, а их физический смысл долгое время оставался непонятным. Причина этого заключалась в том, что в XIX в. совершенно отсутствовали какие-либо представления о сложности строения атома. Данные о строении ядра и о распределении электронов в атомах позволяют рассмотреть периодический закон и периодическую систему элементов с фундаментальных физических позиций. На базе современных представлений периодический закон формулируется так: Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера). Периодическая таблица и электронные конфигурации атомов. В настоящее время известно более 500 вариантов изображения периодической системы: это различные формы передачи периодического закона. Первым вариантом системы элементов, предложенным Д. И. Менделеевым 1 марта 1869 г., был так называемый вариант длинной формы. В этом варианте периоды располагались одной строкой. В декабре 1870 г. он опубликовал второй вариант периодической системы — так называемую короткую форму. В этом варианте периоды разбиваются на ряды, а группы — на подгруппы (главную и побочную). В периодической системе по горизонтали имеется 7 периодов, из них первые три называются малыми, а остальные — большими. В первом периоде находится 2 элемента, во втором и третьем — по 8, в четвертом и пятом — по 18, в шестом — 32, в седьмом (незавершенном) — 21 элемент. Каждый период, за исключением первого” начинается щелочным металлом и заканчивается благородным газом (7-й период — незаконченный). Все элементы периодической системы пронумерованы в том порядке, в каком они следуют друг за другом. Номера элементов называются порядковыми или атомными номерами. В системе 10 рядов. Каждый малый период состоит из одного ряда, каждый большой период — из двух рядов: четного (верхнего) и нечетного (нижнего). В четных рядах больших периодов (четвертом, шестом, восьмом и десятом) находятся одни металлы, и свойства элементов в ряду слева направо изменяются слабо. В нечетных рядах больших периодов (пятого, седьмого и девятого) свойства элементов в ряду слева направо изменяются, как у типических элементов Основным признаком, по которому элементы больших периодов разделены на два ряда, является их степень окисления. Их одинаковые значения дважды повторяются в периоде с ростом атомных масс элементов. Например, в четвертом периоде степени окисления элементов от К до Mn изменяются от +1 до +7, затем следует триада Fe, Со, Ni (это элементы четного ряда), после чего наблюдается такое же возрастание степеней окисления у элементов от Cu до Br (это элементы нечетного ряда). То же мы видим в остальных больших периодах, исключая седьмой, который состоит из одного (четного) ряда. Дважды повторяются в больших периодах и формы соединений элементов. В шестом периоде вслед за лантаном располагаются 14 элементов с порядковыми номерами 58-71, называемых лантаноидами (слово “лантаноиды” означает подобные лантану”, а “актиноиды” — “подобные актинию”). Иногда их называют лантанидами и актинидами, что означает следующие за лантаном, следующие за актинием). Лантаноиды помещены отдельно внизу таблицы, а в клетке звездочкой указано на последовательность их расположения в системе: La-Lu. Химические свойства лантаноидов очень сходны. Например, все они являются реакционно-способными металлами, реагируют с водой с образованием гидроксида и водорода. Из этого следует, что у лантаноидов сильно выражена горизонтальная аналогия. В седьмом периоде 14 элементов с порядковыми номерами 90-103 составляют семейство актиноидов. Их также помещают отдельно — под лантаноидами, а в соответствующей клетке двумя звездочками указано на последовательность их расположения в системе: Ас-Lr. Однако в отличие от лантаноидов горизонтальная аналогия у актиноидов выражена слабо. Они в своих соединениях проявляют больше различных степеней окисления. Например, степень окисления актиния +3, а урана +3, +4, +5 и +6. Изучение химических свойств актиноидов крайне сложно вследствие неустойчивости их ядер. В периодической системе по вертикали расположены восемь групп (обозначены римскими цифрами). Номер группы связан со степенью окисления элементов, проявляемой ими в соединениях. Как правило, высшая положительная степень окисления элементов равна номеру группы. Исключением являются фтор — его степень окисления равна -1; медь, серебро, золото проявляют степень окисления +1, +2 и +3; из элементов VIII группы степень окисления +8 известна только для осмия, рутения и ксенона. В VIII группе размещены благородные газы. Ранее считалось, что они не способны образовывать химические соединения. Каждая группа делится на две подгруппы — главную и побочную, что в периодической системе -подчеркивается смещением одних вправо, а других влево. Главную подгруппу составляют типические элементы (элементы второго и третьего периодов) и сходные с ними по химическим свойствам элементы больших периодов. Побочную подгруппу составляют только металлы — элементы больших периодов. VIII группа отличается от остальных. Кроме главной подгруппы гелия она содержит три побочные подгруппы: подгруппу железа, подгруппу кобальта и подгруппу никеля. Химические свойства элементов главных и побочных подгрупп значительно различаются. Например, в VII группе главную подгруппу составляют неметаллы F, С1, Вг, I, Аt, побочную — металлы Мn, Тc, Rе. Таким образом, подгруппы объединяют наиболее сходные между собой элементы. Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения; существует всего 8 форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RО, R2O3, RO2, R2O5, RО3, R2O7, RO4, где R — элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы (главной и побочной), кроме тех случаев, когда элементы не проявляют степени окисления, равной номеру группы. Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения, форм таких соединений 4. Их также изображают общими формулами в последовательности RН4, RН3, RН2, RН. Формулы водородных соединений располагаются под элементами главных подгрупп и только к ним относятся. Свойства элементов в подгруппах закономерно изменяются: сверху вниз усиливаются металлические свойства и ослабевают неметаллические. Очевидно, металлические свойства наиболее сильно выражены у франция, затем у цезия; неметаллические — у фтора, затем — у кислорода. Наглядно проследить периодичность свойств элементов можно и исходя из рассмотрения электронных конфигураций атомов. Число электронов, находящихся на внешнем уровне в атомах элементов, располагающихся в порядке увеличения порядкового номера, периодически повторяется. Периодическое изменение свойств элементов с увеличением порядкового номера объясняется периодическим изменением строения их атомов, а именно числом электронов на их внешних энергетических уровнях. По числу энергетических уровней в электронной оболочке атома элементы делятся на семь периодов. Первый период состоит из атомов, в которых электронная оболочка состоит из одного энергетического уровня, во втором периоде — из двух, в третьем — из трех, в четвертом — из четырех и т. д. Каждый новый период начинается тогда, когда начинает заполняться новый энергетический уровень. В периодической системе каждый период начинается элементами, атомы которых на внешнем уровне имеют один электрон, — атомами щелочных металлов — и заканчивается элементами, атомы которых на внешнем Уровне имеют 2 (в первом периоде) или 8 электронов (во всех последующих) — атомами благородных газов. Далее мы видим, что внешние электронные оболочки сходны у атомов элементов (Li, Na, К, Rb, Cs); (Ве, Mg, Са, Sr); (F, Сl, Вг, I); (Не, Nе, Аг, Kr, Хе) и т. д. Именно поэтому каждая из вышеприведенных групп элементов оказывается в определенной главной подгруппе периодической таблицы: Li, Na, К, Rb, Cs в I группе, F, Сl, Вг, I — в VII и т. д. Именно вследствие сходства строения электронных оболочек атомов сходны их физические и химические свойства. Число главных подгрупп определяется максимальным числом элементов на энергетическом уровне и равно 8. Число переходных элементов (элементов побочных подгрупп) определяется максимальным числом электронов на d-подуровне и равно 10 в каждом из больших периодов. Поскольку в периодической системе химических элементов Д. И. Менделеева одна из побочных подгрупп содержит сразу три переходных элемента, близких по химическим свойствам (так называемые триады Fe-Со-Ni, Ru-Rh-Pd, Os-Ir-Pt), то число побочных подгрупп, так же как и главных, равно 8. По аналогии с переходными элементами число лантаноидов и актиноидов, вынесенных внизу периодической системы в виде самостоятельных рядов, равно максимальному числу электронов на f-подуровне, т. е. 14. Период начинается элементом, в атоме которого на внешнем уровне находится один s-электрон: в первом периоде это водород, в остальных — щелочные металлы. Завершается период благородным газом: первый — гелием (1s2), остальные периоды — элементами, атомы которых на внешнем уровне имеют электронную конфигурацию ns2np6. Первый период содержит два элемента: водород (Z=1) и гелий (Z= 2). Второй период начинается элементом литием (Z= 3) и завершается неоном (Z = 10). Во втором периоде восемь элементов. Третий период начинается с натрия (Z= 11), электронная конфигурация которого 1s22s22p63s1. С него началось заполнение третьего энергетического уровня. Завершается оно у инертного газа аргона (Z = 18), Зs- и 3p-подуровни которого полностью заполнены. Электронная формула аргона: 1s22s22p6Зs23p6. Натрий — аналог лития, аргон — неона. В третьем периоде, как и во втором, восемь элементов. Четвертый период начинается калием (Z= 19), электронное строение которого выражается формулой 1s22s22p63s23p64s1. Его 19-й электрон занял 4s-подуровень, энергия которого ниже энергии Зd-подуровня. Внешний 4s-электрон придает элементу свойства, сходные со свойствами натрия. У кальция (Z = 20) 4s-подуро-вень заполнен двумя электронами: 1s22s22p63s23р64s2. С элемента скандия (Z = 21) начинается заполнение Зd-подуровня, так как он энергетически более выгоден, чем 4р-подуровень. Пять орбиталей 3d-подуровня могут быть заняты десятью электронами, что осуществляется у атомов от скандия до цинка (Z = 30). Поэтому электронное строение Sc соответствует формуле 1s22s22p63s23p63d14s2, а цинка - 1s22s22p63s23p63d104s2. В атомах последующих элементов вплоть до инертного газа криптона (Z=36) идет заполнение 4p-подуровня. В четвертом периоде 18 элементов. Пятый период содержит элементы от рубидия (Z=37) до инертного газа ксенона (Z = 54). Заполнение их энергетических уровней идет так же, как у элементов четвертого периода: после Rb и Sr у десяти элементов от иттрия (Z = 39) до кадмия (Z=48) заполняется 4d-подуровень, после чего электроны занимают 5p-подуровень. В пятом периоде как и в четвертом, 18 элементов. В атомах элементов шестого периода цезия (Z= 55) и бария (Z = 56) заполняется 6s-подуровень. У лантана (Z= 57) один электрон поступает на 5d-подуровень, после чего заполнение этого подуровня приостанавливается, а начинает заполняться 4f-поАуровень, семь орбиталей которого могут быть заняты 14 электронами. Это происходит у атомов элементов лантаноидов с Z = 58 — 71. Поскольку у этих элементов заполняется глубинный 4f-подуровеиь третьего снаружи уровня, они обладают весьма близкими химическими свойствами. С гафния (Z = 72) возобновляется заполнение d-подуровня и заканчивается у ртути (Z = 80), после чего электроны заполняют 6p-подуровень. Заполнение уровня завершается у благородного газа радона (Z= 86). В шестом периоде 32 элемента. Седьмой период — незавершенный. Заполнение электронами электронных уровней аналогично шестому периоду. После заполнения 7s-подуровня у Франция (Z = 87) и радия (Z = 88) электрон актиния поступает на 6d-подуровень, после которого начинает заполняться 5f-подуровень 14 электронами. Это происходит у атомов элементов актиноидов с Z = 90 — 103. После 103-го элемента идет заполнение б d-подуровня: у курчатовия (Z = 104), нильсбория (Z =105), элементов Z = 106 и Z = 107. Актиноиды, как и лантаноиды, обладают многими сходными химическими свойствами. Хотя 3 d-подуровень заполняется после 4s-подуровня, в формуле он ставится раньше, так как последовательно записываются все подуровни данного уровня. В зависимости от того, какой подуровень последним заполняется электронами, все элементы делят на четыре типа (семейства). 1. s-Элементы: заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. 2. р-Элементы: заполняется электронами р-подуровень внешнего уровня. Это последние 6 элементов каждого периода (кроме первого и седьмого). 3. d-Элементы: заполняется электронами d-подуровень второго снаружи уровня, а на внешнем уровне остается один или два эле трона (у Pd — нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s- и р-элементами (их также называют переходными элементами). 4. f-Элементы: заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды. В периодической системе s-элементов 14, р-элементов 30, d-элементов 35, f-элементов 28. Элементы одного типа имеют ряд общих химических свойств. Периодическая система Д. И. Менделеева является естественной классификацией химических элементов по электроны структуре их атомов. Об электронной структуре атома, а значит, и свойствах элемента судят по положению элемента в соответствующем периоде и подгруппе периодической системы. Закономерностями заполнения электронных уровней объясняется различное число элементов в периодах. Таким образом, строгая периодичность расположения элементов в периодической системе химических элементов Д. И. Менделеева полностью объясняется последовательным характером заполнения энергетических уровней. Выводы: Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание положительных зарядов атомных ядер от 1 до 107 обусловливает периодическое повторение строения внешнего энергетического уровня. А поскольку свойства элементов в основном зависят от числа электронов на внешнем уровне, то и они периодически повторяются. В этом — физический смысл периодического закона. В малых периодах с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 — в первом периоде, и от 1 до 8 — во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого периода) находится щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются свойства неметаллические. В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что объясняет и более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда число электронов на внешнем уровне остается постоянным и равно 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в этих рядах изменяются крайне медленно. Лишь в нечетных рядах, когда с ростом заряда ядра увеличивается число электронов на внешнем уровне (от 1 до 8), свойства элементов начинают изменяться так же, как у типических. В свете учения о строении атомов становится обоснованным разделение Д.И. Менделеевым всех элементов на семь периодов. Номер периода соответствует числу энергетических уровней атомов, заполняемых электронами. Поэтому s-элементы имеются во всех периодах, р-элементы — во втором и последующих, d-элементы — в четвертом и последующих и f-элементы — в шестом и седьмом периодах. Легко объяснимо и деление групп на подгруппы, основанное на различии в заполнении электронами энергетических уровней. У элементов главных подгрупп заполняются или s-подуровни (это s-элементы), или р-подуровни (это р-элементы) внешних уровней. У элементов побочных подгрупп заполняется (d-подуровень второго снаружи уровня (это d-элементы). У лантаноидов и актиноидов заполняются соответственно 4f- и 5f-подуровни (это f-элементы). Таким образом, в каждой подгруппе объединены элементы, атомы которых имеют сходное строение внешнего электронного уровня. При этом атомы элементов главных подгрупп содержат на внешних уровнях число электронов, равное номеру группы. В побочные же подгруппы входят элементы, атомы которых имеют на внешнем уровне по д ва или по одному электрону. Различия в строении обусловливают и различия в свойствах элементов разных подгрупп одной группы. Так, на внешнем уровне атомов элементов подгруппы галогенов имеется по семь электронов подгруппы марганца — по два электрона. Первые — типичные металлы, а вторые — металлы. Но у элементов этих подгрупп есть и общие свойства: вступая в химические реакции, все они (за исключением фтора F) могут отдавать по 7 электронов на образование химических связей. При этом атомы подгруппы марганца отдают 2 электрона с внешнего и 5 электронов со следующего за ним уровня. Таким образом, у элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних (вторых снаружи) уровней, в чем состоит основное различие в свойствах элементов главных и побочных подгрупп. Отсюда же следует, что номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом — физический смысл номера группы. Итак, строение атомов обусловливает две закономерности: 1) изменение свойств элементов по горизонтали — в периоде слева право ослабляются металлические и усиливаются неметаллические свойства; 2) изменение свойств элементов по вертикали — в подгруппе с ростом порядкового номера усиливаются металлические свойства и ослабевают неметаллические. В таком случае элемент (и клетка системы) находится на пересечении горизонтали и вертикали, что определяет его свойства. Это помогает находить и писывать свойства элементов, изотопы которых получают искусственным путем. 1. Основные классы неорганических веществ В настоящее время известно более 500 тысяч неорганических соединений, знать их формулы, названия, а тем более свойства практически невозможно. Для того чтобы легче ориентироваться в огромном многообразии химических веществ, все вещества разделены на отдельные классы, включающие соединения, сходные по строению и свойствам. Первоначально все химические вещества делятся на простые и сложные. Простые вещества подразделяются на металлы и неметаллы. Помимо типичных металлов и неметаллов есть большая группа веществ, обладающая промежуточными свойствами, их называют металлоидами. Сложные вещества подразделяются на четыре класса химических соединений: оксиды, основания, кислоты и соли. Эта классификация разработана выдающимися химиками XVIII–XIX веков Антуаном Лораном Лавуазье, Михаилом Васильевичем Ломоносовым, Йёнсом Якобом Берцелиусом, Джоном Дальтоном.
Химическая связь Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.) в вещества делятся на химические связи и межмолекулярные связи (межмолекулярные взаимодействия). Химические связи - связи непосредственно между атомами. Различают ионную, ковалентную и металлическую связь. Межмолекулярные связи - связи между молекулами. Это водородная связь, ион-дипольная связь (за счет образования этой связи происходит, например, образование гидратной оболочки ионов), диполь-дипольная (за счет образования этой связи объединяются молекулы полярных веществ, например, в жидком ацетоне) и др. Ионная связь - химическая связь, образованная за счет электростатического притяжения разноименно заряженных ионов. В бинарных соединениях (соединениях двух элементов) она образуется в случае, когда размеры связываемых атомов сильно отличаются друг от друга: одни атомы большие, другие маленькие - то есть одни атомы легко отдают электроны, а другие склонны их принимать (обычно это атомы элементов, образующих типичные металлы и атомы элементов, образующих типичные неметаллы); электроотрицательность таких атомов также сильно отличается. Ковалентная связь - химическая связь, возникающая за счет образования общей пары электронов. Ковалентная связь образуется между маленькими атомами с одинаковыми или близкими радиусами. Необходимое условие - наличие неспаренных электронов у обоих связываемых атомов (обменный механизм) или неподеленной пары у одного атома и свободной орбитали у другого (донорно-акцепторный механизм):
По числу общих электронных пар ковалентные связи делятся на простые (одинарные) - одна пара электронов, двойные - две пары электронов, тройные - три пары электронов. Двойные и тройные связи называются кратными связями. По распределению электронной плотности между связываемыми атомами ковалентная связь делится на неполярную и полярную. Неполярная связь образуется между одинаковыми атомами, полярная - между разными. Электроотрицательность - мера способности атома в веществе притягивать к себе общие электронные пары. По характеру перекрывания электронных облаков (" орбиталей") ковалентная связь делится на Ковалентная связь обладает направленностью и насыщаемостью, а также поляризуемостью. Гибридизация атомных орбиталей и электронных облаков - предполагаемое выравнивание атомных орбиталей по энергии, а электронных облаков по форме при образовании атомом ковалентных связей. Металлическая связь - химическая связь, образованная за счет обобществления валентных электронов всех связываемых атомов металлического кристалла. В результате образуется единое электронное облако кристалла, которое легко смещается под действием электрического напряжения - отсюда высокая электропроводность металлов. Водородная связь - межмолекулярная связь, образованная за счет частичного акцептирования пары электронов высокоэлектроотрицательнного атома атомом водорода с большим положительным частичным зарядом. Образуется в тех случаях, когда в одной молекуле есть атом с неподеленной парой электронов и высокой электроотрицательностью (F, O, N), а в другой - атом водорода, связанный сильно полярной связью с одним из таких атомов. Примеры межмолекулярных водородных связей: H—O—H ··· OH2, H—O—H ··· NH3, H—O—H ··· F—H, H—F ··· H—F. Внутримолекулярные водородные связи существуют в молекулах полипептидов, нуклеиновых кислот, белков и др. Мерой прочности любой связи является энергия связи. Энергии ионной и ковалентной связи - одного порядка, энергия водородной связи - на порядок меньше. Энергия ковалентной связи зависит от размеров связываемых атомов (длины связи) и от кратности связи. Чем меньше атомы и больше кратность связи, тем больше ее энергия. Энергия ионной связи зависит от размеров ионов и от их зарядов. Чем меньше ионы и больше их заряд, тем больше энергия связи. Строение вещества По типу строения все вещества делятся на молекулярные и немолекулярные. Среди органических веществ преобладают молекулярные вещества, среди неорганических - немолекулярные. По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы). Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах. Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H2, O2, N2, Cl2, Br2, S8, P4 и другие простые вещества; CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, C2H5OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях. Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO2, SiC и другие) образуют очень прочные кристаллы (исключение - слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников - кремния, германия и пр.) Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде. Следует отметить, что в ионных веществах, кристаллы которых состоят из сложных ионов, есть и ковалентные связи, например: (Na+)2(SO42-), (K+)3(PO43-), (NH4+)(NO3-) и т. д. Ковалентными связями связаны атомы, из которых состоят сложные ионы. Металлы (вещества с металлической связью) очень разнообразны по своим физическим свойствам. Среди них есть жидкость (Hg), очень мягкие (Na, K) и очень твердые металлы (W, Nb). Характерными физическими свойствами металлов является их высокая электропроводность (в отличие от полупроводников, уменьшается с ростом температуры), высокая теплоемкость и пластичность (у чистых металлов). В твердом состоянии почти все вещества состоят из кристаллов. По типу строения и типу химической связи кристаллы (" кристаллические решетки") делят на атомные (кристаллы немолекулярных веществ с ковалентной связью), ионные (кристаллы ионных веществ), молекулярные (кристаллы молекулярных веществ с ковалентной связью) и металлические (кристаллы веществ с металлической связью).
|

 H: H
H: H
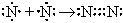
 N
N
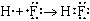
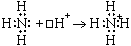
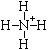
 + и
+ и  .
. -связь и
-связь и  -связь.
-связь.


