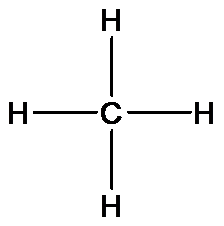
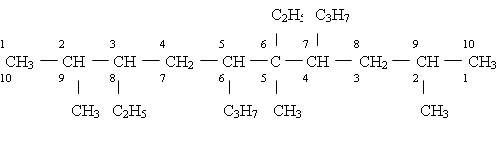Тема: Теория химического строения органических веществ. Изомерия. Классификация. Номенклатура. УглеводородыПредставления о валентности составили важную часть теории химического строения А.М. Бутлерова в 1861 г. Периодический закон, сформулированный Д.И. Менделеевым в 1869 г., вскрыл зависимость валентности элемента от его положения в периодической системе. Оставалось неясным большое многообразие органических веществ, имеющих одинаковый качественный и количественный состав, но разные свойства. К примеру, было известно около 80 разнообразных веществ, отвечающих составу C6H12O2. Йенс Якоб Берцелиус предложил называть эти вещества изомерами. Ученые многих стран своими работами подготовили почву для создания теории, объясняющей строение и свойства органических веществ. На съезде немецких естествоиспытателей и врачей в городе Шпейере был прочитан доклад, называвшийся “Нечто в химическом строении тел”. Автором доклада был профессор Казанского университета Александр Михайлович Бутлеров. Именно это самое “нечто” и составило теорию химического строения, которая легла в основу наших современных представлений о химических соединениях. Органическая химия получила прочную научную основу, обеспечившую ее стремительное развитие в последующее столетие вплоть до наших дней. Эта теория позволила предсказывать существование новых соединений и их свойства. Понятие о химическом строении позволило объяснить такое загадочное явление, как изомерия. Основные положения теории химического строения сводятся к следующему: 2. Свойства веществ определяются качественным, количественным составом, порядком соединения и взаимным влиянием атомов и групп атомов в молекуле. 3. Строение молекул может быть установлено на основе изучения их свойств. Рассмотрим эти положения более подробно. Молекулы органических веществ содержат атомы углерода (валентность IV), водорода (валентность I), кислорода (валентность II), азота (валентность III). Каждый атом углерода в молекулах органических веществ образует четыре химические связи с другими атомами, при этом атомы углерода могут соединяться в цепи и кольца. На основании первого положения теории химического строения мы будем составлять структурные формулы органических веществ. Например, установлено, что метан имеет состав СН4. Учитывая валентности атомов углерода и водорода можно предложить только одну структурную формулу метана:
Химическое строение других органических веществ может быть описано следующими формулами:
этан
этиловый спирт
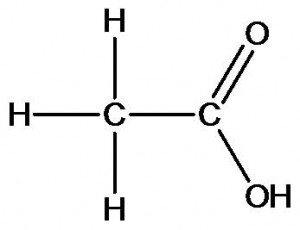
уксусная кислота
ацетон Второе положение теории химического строения описывает известную нам взаимосвязь: состав — строение — свойства. Посмотрим проявление этой закономерности на примере органических веществ. Этан и этиловый спирт имеют разный качественный состав. Молекула спирта в отличие от этана содержит атом кислорода. Как это скажется на свойствах?
Введение в молекулу атома кислорода резко меняет физические свойства вещества. Это подтверждает зависимость свойств от качественного состава. Сравним состав и строение углеводородов метана, этана, пропана и бутана.
пропан
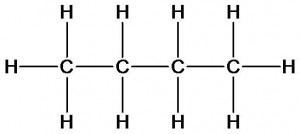
бутан Метан, этан, пропан и бутан имеют одинаковый качественный состав, но разный количественный (число атомов каждого элемента). Согласно второму положению теории химического строения они должны обладать различными свойствами.
Как видно из таблицы, с увеличением числа атомов углерода в молекуле происходит повышение температур кипения и плавления, что подтверждает зависимость свойств от количественного состава молекул. Молекулярной формуле С4Н10 соответствует не только бутан, но и его изомер изобутан:
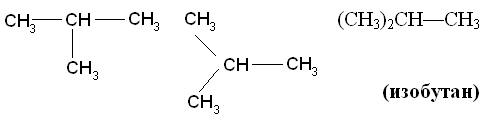
Изомеры имеют одинаковый качественный (атомы углерода и водорода) и количественный (4 атома углерода и десять атомов водорода) состав, но отличаются друг от друга порядком соединения атомов (химическим строением). Посмотрим как различие в строении изомеров скажется на их свойствах.
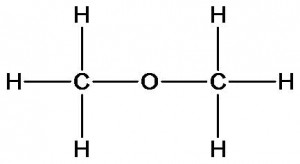
Углеводород разветвленного строения (изобутан) имеет более высокие температуры кипения и плавления, чем углеводород нормального строения (бутан). Это можно объяснить более близким расположением молекул друг к другу в бутане, что повышает силы межмолекулярного притяжения и, следовательно, требует больших затрат энергии для их отрыва. Третье положение теории химического строения показывает обратную связь состава, строения и свойств веществ: состав — строение — свойства. Рассмотрим это на примере соединений состава С2Н6О. Представим, что у нас имеются образцы двух веществ с одинаковой молекулярной формулой С2Н6О, которая была определена в ходе качественного и количественного анализа. Но как узнать химическое строение этих веществ? Ответить на этот вопрос поможет изучение их физических и химических свойств. При взаимодействии первого вещества с металлическим натрием реакция не идет, а второе – активно с ним взаимодействует с выделением водорода. Определим количественное отношение веществ в реакции. Для этого к известной массе второго вещества прибавим определенную массу натрия. Измерим объем водорода. Вычислим количества веществ. При этом окажется, что из двух моль исследуемого вещества выделяется один моль водорода. Следовательно, каждая молекула этого вещества является источником одного атома водорода. Какой вывод можно сделать? Только один атом водорода отличается по свойствам и значит строением (с какими атомами связан) от всех остальных. Учитывая валентность атомов углерода, водорода и кислорода для данного вещества может быть предложена только одна формула:
Для первого вещества может быть предложена формула, в которой все атомы водорода имеют одинаковое строение и свойства:
Аналогичный результат можно получить и при изучении физических свойств этих веществ.
Таким образом, на основании изучения свойств веществ можно сделать вывод о его химическом строении. Значение теории химического строения трудно переоценить. Она вооружила химиков научной основой для изучения строения и свойств органических веществ. Подобное значение имеет и Периодический закон, сформулированный Д.И. Менделеевым. Теория строения обобщила все научные взгляды, сложившиеся в химии того времени. Ученые смогли объяснить поведение органических веществ в ходе химических реакций. На основе теории А.М. Бутлеров предсказал существование изомеров некоторых веществ, которые позднее были получены. Так же как и Периодический закон, теория химического строения получила свое дальнейшее развитие после становления теории строения атома, химической связи и стереохимии. Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства Явление существования изомеров называется изомерией
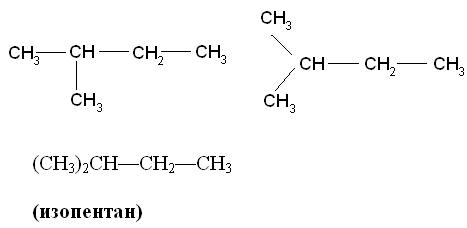
Например, вещество состава С4Н10 имеет два изомерных соединения. Физические свойства бутана и изобутана отличаются: изобутан имеет более низкие температуры плавления и кипения, чем н.бутан.
Химические свойства данных изомеров различаются незначительно, т.к. они имеют одинаковые качественный состав и характер связи между атомами в молекуле. По- другому определение изомеров можно дать так: Изомеры – вещества, имеющие одинаковую молекулярную, но разную структурную формулу. Виды изомерии
В зависимости от характера отличий в строении изомеров различают структурную и пространственную изомерию. Структурные изомеры - соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением.
Структурная изомерия
Пространственные изомеры (стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле
Оптические изомеры еще называют зеркальными или хиральными (как левая и правая рука) Структурные изомеры Структурные изомеры – соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением. Следовательно, структурные изомеры имеют одну и ту же молекулярную формулу, но различные структурные формулы. Типы структурной изомерии Изомерия углеродного скелета
Изомерия положения:
б) функциональной группы
Межклассовая изомерия (изомерия функциональных групп)
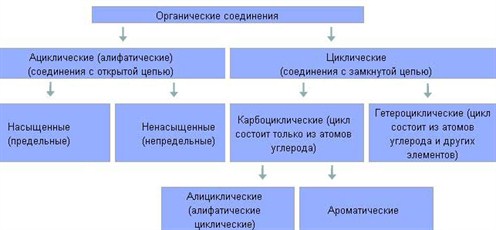
Классификация Органических соединений много, но среди них имеются соединения с общими и сходными свойствами. Поэтому все они по общим признакам классифицированы, объединены в отдельные классы и группы. В основе классификации лежат углеводороды – соединения, которые состоят только из атомов углерода и водорода. Остальные органические вещества относятся к «Другим классам органических соединений».
Ациклические соединения (жирные или алифатические) – соединения, молекулы которых содержат открытую (незамкнутую в кольцо) неразветвленную или разветвленную углеродную цепь с простыми или кратными связями. Ациклические соединения подразделяются на две основные группы: • насыщенные (предельные) углеводороды (алканы), у которых все атомы углерода связаны между собой только простыми связями; • ненасыщенные (непредельные) углеводороды, у которых между атомами углерода кроме одинарных простых связей, имеются также и двойные, и тройные связи. Ненасыщенные (непредельные) углеводороды делятся на три группы: алкены, алкины и алкадиены. Алкены (олефины, этиленовые углеводороды) – ациклические непредельные углеводороды, которые содержат одну двойную связь между атомами углерода, образуют гомологический ряд с общей формулой CnH2n. Названия алкенов образуются от названий соответствующих алканов с заменой суффикса «-ан» на суффикс «-ен». Например, пропен, бутен, изобутилен или метилпропен. Алкины (ацетиленовые углеводороды) – углеводороды, которые содержат тройную связь между атомами углерода, образуют гомологический ряд с общей формулой CnH2n-2. Названия алкенов образуются от названий соответствующих алканов с заменой суффикса «-ан» на суффикс «-ин». Например, этин (ацителен), бутин, пептин. Алкадиены – органические соединения, которые содержат две двойные связи углерод-углерод. В зависимости от того, как располагаются двойные связи относительно друг друга диены делятся на три группы: сопряженные диены, аллены и диены с изолированными двойными связями. Обычно к диенам относят ациклические и циклические 1, 3-диены, образующие с общими формулами CnH2n-2 и CnH2n-4. Ациклические диены являются структурными изомерами алкинов. Циклические соединения в свою очередь делятся на две большие группы: карбоциклические соединения – соединения, циклы которых состоят только из атомов углерода; Карбоциклические соединения подразделяются на алициклические – насыщенные (циклопарафины) и ароматические; гетероциклические соединения – соединения, циклы которых состоят не только из атомов углерода, но атомов других элементов: азота, кислорода, серы и др. В молекулах как ациклических, так и циклических соединений атомы водорода можно замещать на другие атомы или группы атомов, таким образом, с помощью введения функциональных групп можно получать производные углеводородов. Это свойство ещё больше расширяет возможности получения различных органических соединений и объясняет их многообразие. Наличие тех или иных групп в молекулах органических соединений обуславливает общность их свойств. На этом основана классификация производных углеводородов.
Спирты получаются замещением одного или нескольких атомов водорода гидроксильными группами – OH. Это соединение с общей формулой R – (OH)х, где х – число гидроксильных групп. Альдегиды содержат альдегидную группу (С = О), которая всегда находится в конце углеводородной цепи. Карбоновые кислоты содержат в своём составе одну или несколько карбоксильных групп – COOH. Сложные эфиры – производные кислородосодержащих кислот, которые формально являются продуктами замещения атомов водорода гидроокислов – OH кислотной функции на углеводородный остаток; рассматриваются также как ацилпроизводные спиртов. Жиры (триглицериды) – природные органические соединения, полные сложные эфиры глицерина и односоставных жирных кислот; входят в класс липидов. Природные жиры содержат в своём составе три кислотных радикала с неразветвлённой структурой и, обычно, чётное число атомов углерода. Углеводы – органические вещества, которые содержат содержащими неразветвленную цепь из нескольких атомов углерода, карбоксильную группу и несколько гидроксильных групп. Амины содержат в своём составе аминогруппу – NH2 Аминокислоты – органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Белки – высокомолекулярные органические вещества, которые состоят состоящие из альфа – аминокислот, соединённых в цепочку пептидной связью. Нуклеиновые кислоты – высокомолекулярные органические соединения, биополимеры, образованные остатками нуклеотидов. Все органические соединения в зависимости от природы углеродного скелета можно разделить на ациклические и циклические. Ациклические (нециклические, цепные) соединения называют также жирными или алифатическими. Эти названия связаны с тем, что одними из первых хорошо изученных соединений такого типа были природные жиры. Среди ациклических соединений различают предельные, например:
и непредельные, например:
Среди циклических соединений обычно выделяют карбо-циклические, молекулы которых содержат кольца из углеродных атомов, и гетероциклические, кольца которых содержат кроме углерода атомы других элементов (кислорода, серы, азота и др.). Карбоциклические соединения подразделяются на алициклические (предельные и непредельные), похожие по свойствам на алифатические, и ароматические, которые содержат бензольные кольца. Примеры
Рассмотренную классификацию органических соединений можно представить в виде краткой схемы
В состав многих органических соединений кроме углерода и водорода входят и другие элементы, причем в виде функциональных групп - групп атомов, определяющих химические свойства данного класса соединений. Наличие этих групп позволяет подразделить указанные выше типы органических соединений на классы и облегчить их изучение. Некоторые наиболее характерные функциональные группы и соответствующие им классы соединений приведены в таблице
В состав молекул органических соединений могут входить две или более одинаковых или различных функциональных групп, например:
Номенклатура В настоящее время для наименования органических соединений применяются три типа номенклатуры: тривиальная, рациональная и систематическая номенклатура — номенклатура IUPAC (ИЮПАК) — International Union of Pure and Applied Chemistry (Международного союза теоретической и прикладной химии). Тривиальная (историческая) номенклатура — первая номенклатура, возникшая в начале развития органической химии, когда не существовало классификации и теории строения органических соединений. Органическим соединениям давали случайные названия по источнику получения (щавелевая кислота, яблочная кислота, ванилин), цвету или запаху (ароматические соединения), реже — по химическим свойствам (парафины). Многие такие названия часто применяются до сих пор. Например: мочевина, толуол, ксилол, индиго, уксусная кислота, масляная кислота, валериановая кислота, гликоль, аланин и многие другие. Рациональная номенклатура — по этой номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматриваются как производные этого соединения, образованные замещением в нем атомов водорода углеводородными или иными радикалами (например: триметилуксусный альдегид, метиламин, хлоруксусная кислота, метиловый спирт). В настоящее время такая номенклатура применяется только в тех случаях, когда она дает особенно наглядное представление о соединении. Систематическая номенклатура— номенклатура IUPAC — международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название каждого органического соединения должно содержать правильные названия функций (заместителей) и основного скелета углеводорода и должно быть таким, чтобы по названию можно было написать единственно правильную структурную формулу. Процесс создания международной номенклатуры был начат в 1892 г. (Женевская номенклатура), продолжен в 1930 г. (Льежская номенклатура), с 1947 г. дальнейшее развитие связано с деятельностью комиссии ИЮПАК по номенклатуре органических соединений. Публиковавшиеся в разные годы правила ИЮПАК собраны в 1979 г. в “ голубой книге ” [Nomenclature of Organic Chemistry, Section A, B, C, D, E, F and H, Oxford Pergamon Press, 1979]. Своей задачей комиссия ИЮПАК считает не создание новой, единой системы номенклатуры, а упорядочение, “кодификацию”, имеющейся практики. Результатом этого является сосуществование в правилах ИЮПАК нескольких номенклатурных систем, а, следовательно, и нескольких допустимых названий для одного и того же вещества. Правила ИЮПАК опираются на следующие системы: заместительную, радикало-функциональную, аддитивную (соединительную), заменительную номенклатуру и т.д. В заместительной номенклатуре основой названия служит один углеводородный фрагмент, а другие рассматриваются как заместители водорода (например, (C6H5)3CH – трифенилметан). В радикало-функциональной номенклатуре в основе названия лежит название характеристической функциональной группы, определяющей химический класс соединения, к которому присоединяют наименование органического радикала, например: C2H5OH — этиловый спирт; C2H5Cl — этилхлорид; CH3–O–C2H5 — метилэтиловый эфир; CH3–CO–CH = CH2 — метилвинилкетон. В соединительной номенклатуре название составляют из нескольких равноправных частей (например, C6H5–C6H5 бифенил) или добавляя обозначения присоединенных атомов к названию основной структуры (например, 1, 2, 3, 4-тетрагидронафталин, гидрокоричная кислота, этиленоксид, стиролдихлорид). Заменительную номенклатуру применяют при наличии неуглеродных атомов (гетероатомов) в молекулярной цепи: корни латинских названий этих атомов с окончанием “а” (а-номенклатура) присоединяют к названиям всей структуры, которая получилась бы, если бы вместо гетероатомов был углерод (например, CH3–O–CH2–CH2–NH–CH2–CH2–S–CH3 2-окса-8-тиа-5-азанонан). Система ИЮПАК является общепризнанной в мире, и лишь адаптируется соответственно грамматике языка страны. Полный набор правил применения системы ИЮПАК ко многим менее обычным типам молекул длинен и сложен. Здесь представлено лишь основное содержание системы, но это позволяет осуществлять наименование соединений, для которых применяется система. Углеводороды Названия первых четырех предельных углеводородов тривиальные (исторические названия) — метан, этан, пропан, бутан. Начиная с пятого, названия образованы греческими числительными, соответствующими количеству атомов углерода в молекуле, с добавлением суффикса " –АН", за исключением числа " девять", когда корнем служит латинское числительное " нона". Таблица 1. Названия предельных углеводородов
1.1.1. Одновалентные радикалы Одновалентные радикалы, образованные из насыщенных неразветвленных предельных углеводородов отнятием водорода от конечного углеродного атома, называют заменяя суффикс" –АН" в названии углеводорода суффиксом " –ИЛ". Атом углерода со свободной валентностью получает номер? Эти радикалы называют нормальными или неразветвленными алкилами: СН3– — метил; СН3–СН2–СН2–СН2– — бутил; СН3–СН2–СН2–СН2–СН2–СН2– — гексил. Таблица 2. Названия углеводородных радикалов
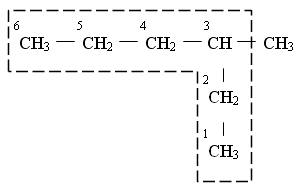
1.2. Насыщенные разветвленные соединения с одним заместителем Номенклатура ИЮПАК для алканов в индивидуальных названиях сохраняет принцип Женевской номенклатуры. Называя алкан, исходят из названия углеводорода, отвечающего самой длиной углеродной цепи в данном соединении (главная цепь), а затем указывают радикалы, примыкающие к этой основной цепи. Главная углеродная цепь, во-первых, должна быть самой длинной, во-вторых, если имеются две или более одинаковые по длине цепи, то из них выбирается наиболее разветвленная. *Для названия насыщенных разветвленных соединений выбирают самую длинную цепочку из атомов углерода:
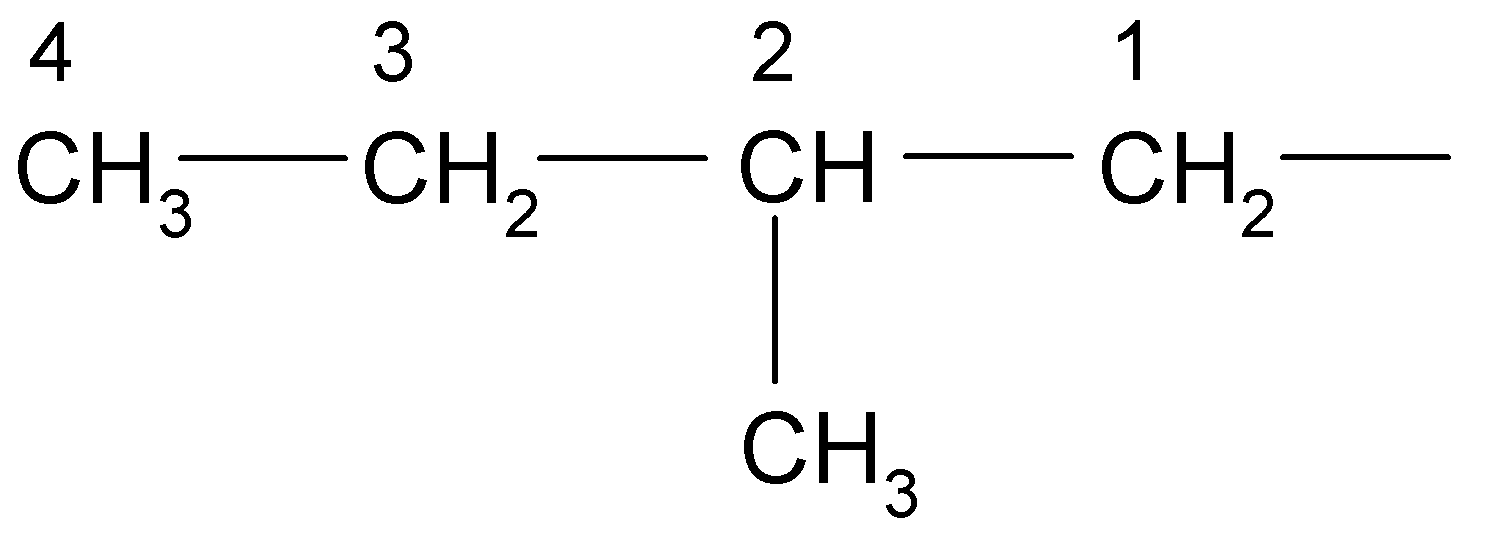
*Нумеруют выбранную цепь от одного конца до другого арабскими цифрами, причем, нумерацию начинают с того конца, к которому ближе находится заместитель:
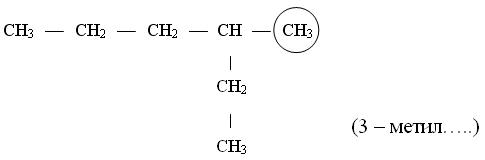
*Указывают положение заместителя (номер атома углерода, у которого находиться алкильный радикал):
*Называют алкильный радикал в соответствии с его положением в цепи:
*Называют основную (самую длинную углеродную цепь):
Если заместителем будет являться галоген (фтор, хлор, бром, йод), то все номенклатурные правила сохраняются:
Тривиальные названия сохраняются только для следующих углеводородов:
Если в углеводородной цепи находятся, несколько одинаковых заместителей, то перед их названием ставится приставка “ди”, “три”, “тетра”, “пента”, “гекса” и т.д., обозначающая число присутствующих групп:
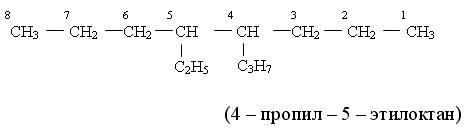
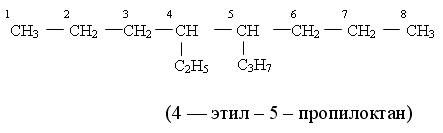
1.3. Насыщенные разветвлнные соединения с несколькими заместителями При наличии двух и более разных боковых цепей, их можно перечислять: а) в алфавитном порядке или б) в порядке возрастания сложности. а) При перечислении разных боковых цепей в алфавитном порядке умножающие префиксы не учитываются. Сперва названия атомов и групп располагают в алфавитном порядке, а затем вставляют умножающие префиксы и цифры местоположения (локанты):
2-метил-5-пропил-3, 4-диэтилоктан б) При перечислении боковых цепей в порядке возрастания сложности исходят из следующих принципов: Менее сложной является цепь, у которой общее число углеродных атомов меньше, например:
менее сложна, чем
Если общее число атомов углерода в разветвленном радикале одинаково, то менее сложной будет боковая цепь с наиболее длинной основной цепочкой радикала, например:
менее сложна, чем
Если две или более боковые цепи находятся в равнозначном положении, то более низкий номер получает та цепь, которая в названии перечисляется первой, независимо от того, соблюдается ли порядок возрастающей сложности или алфавитный: а) алфавитный порядок:
б) порядок расположения по сложности:
Если в углеводородной цепи находятся несколько углеводородных радикалов и они различны по сложности, а при нумерации получаются различающиеся ряды нескольких цифр, их сравнивают, расположив цифры в рядах в порядке возрастания. “Наименьшими” считают цифры того ряда, в котором первая отличающаяся цифра меньше (например: 2, 3, 5 меньше, чем 2, 4, 5 или 2, 7, 8 меньше, чем 3, 4, 9). Этот принцип соблюдается независимо от природы заместителей. В некоторых справочниках для определения выбора нумерации используют сумму цифр, нумерацию начинают с той стороны, где сумма цифр, обозначающих положение заместителей, наименьшая:
2, 3, 5, 6, 7, 9 — ряд цифр наименьший 2, 4, 5, 6, 8, 9 или 2+3+5+6+7+9 = 32 — сумма номеров заместителей наименьшая 2+4+5+6+8+9 = 34 следовательно, углеводородную цепь нумеруют слева направо, тогда название углеводорода будет: (2, 6, 9–триметил–5, 7–дипропил–3, 6–диэтилдекан)
(2, 2, 4–триметилпентан, но не 2, 4, 4–триметилпентан) Если в углеводородной цепи находится, несколько различных заместителей (например, углеводородные радикалы и галогены), то перечисление заместителей производится либо в алфавитном порядке, либо в порядке возрастания сложности (фтор, хлор, бром, йод):
а) алфавитный порядок 3–бром–1–иод –2–метил –5–хлорпентан; б) порядок возрастания сложности: 5–хлор–3–бром–1–иод–2–метилпентан.
|







 Шаростержневая модель молекулы бутана
Шаростержневая модель молекулы бутана 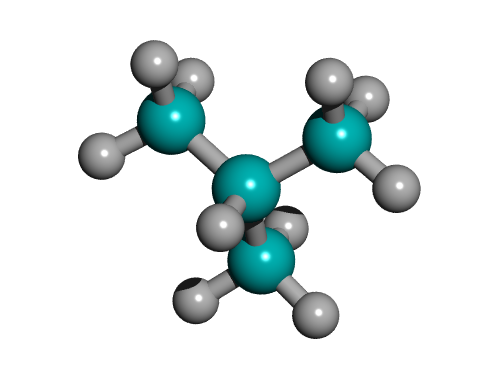 Шаростержневая модель молекулы изобутана
Шаростержневая модель молекулы изобутана





 Углеводороды делятся на два больших класса: ациклические и циклические соединения.
Углеводороды делятся на два больших класса: ациклические и циклические соединения. К «Другим классам органических соединений» относятся следующие:
К «Другим классам органических соединений» относятся следующие: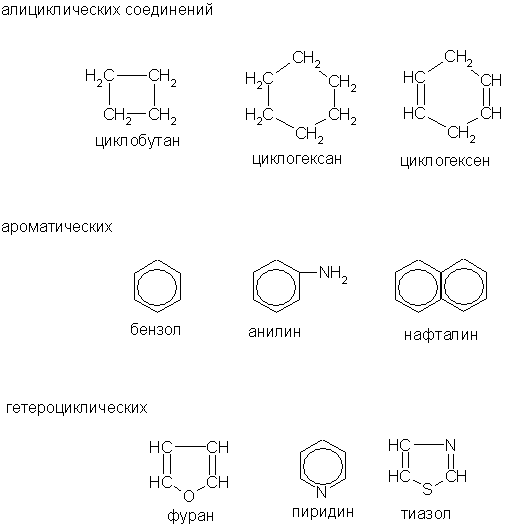

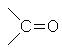
 фенол
фенол
 уксусный альдегид
уксусный альдегид
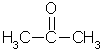 ацетон
ацетон

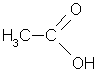 уксусная кислота
уксусная кислота
 анилин
анилин

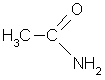 амид уксусной кислоты
амид уксусной кислоты