Термодинамическое условие химического равновесия
Термодинамическим условием равновесия процесса, протекающего в изобарно-изотермических условиях, является равенство нулю изменения энергии Гиббса (D rG (Т)=0). При протекании реакции n аA + n bB = n сC + n dD изменение стандартной энергии Гиббса равно: D rG 0 T =(n c × D fG 0 C + n d × D fG 0 D )–(n a × D fG 0 A + n b × D fG 0 B ). Данное выражение соответствует идеальному процессу, в котором концентрации реагирующих веществ равны единице и неизменны в ходе реакции. В ходе реальных процессов концентрации реагентов меняются: концентрация исходных веществ уменьшается, а продуктов реакции увеличивается. С учетом концентрационной зависимости энергии Гиббса (см. п. 1. 3. 4) ее изменение в ходе реакции равно: D rGT =[n c × (D fG 0 C + R × T × ln CC) + n d × (D fG 0 D + R × T × ln CD)]– – [n a × (D fG 0 A + R × T × ln CA) + n b × (D fG 0 B + R × T × ln CB)] = =(n c × D fG 0 C + n d × D fG 0 D )–(n a × D fG 0 A + n b × D fG 0 B ) + + R × T × (n c × ln CC + n d × ln CD –n a × ln CA –n b × ln CB) D rGT =D rG 0 T + R × T × где В состоянии равновесия D rG 0 T + R× T ×
Величина К 0 называется стандартной (термодинамичской) константой равновесия реакции. То есть при определенной температуре Т в результате протекания прямой и обратной реакции в системе устанавливается равновесие при определенных концентрациях реагирующих веществ – равновесных концентрациях (Сi)р. Величины равновесных концентраций определяются значением константы равновесия, которая является функцией температуры, и зависит от энтальпии (D rН 0) и энтропии (D rS 0) реакции: D rG 0 T + R × T × ln K 0= 0,
поскольку D rG 0 T =D rН 0 T – Т × D rS 0 T,
Если известны величины энтальпии (D rН 0 T) и энтропии (D rS 0 T) или D rG 0 T реакции, то можно вычислить значение стандартной константы равновесия. Константа равновесия реакции характеризует идеальные газовые смеси и растворы. Межмолекулярные взаимодействия в реальных газах и растворах приводят к отклонению расчетных величин констант равновесия от реальных. Для учета этого вместо парциальных давлений компонентов газовых смесей используется их фугитивность, а вместо концентрации веществ в растворах их активность. Фугитивность i -го компонента связана с его парциальным давлением соотношением fi =g i × pi, где g i – коэффициент фугитивности.Активность и концентрация компонента связаны соотношением аi =g i × Сi, где g i – коэффициент активности. Необходимо отметить, что в достаточно широкой области давлений и температур газовые смеси можно считать идеальными и проводить расчеты равновесного состава газовой смеси, считая коэффициент фугитивности g i @ 1.В случае жидких растворов, особенно растворов электролитов, коэффициенты активности их компонентов могут значительно отличаться от единицы (g i ¹ 1) и для расчета равновесного состава необходимо использовать активности.
|

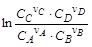 ,
,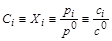 – безразмерная концентрация i -го вещества; Xi – мольная доля i -го вещества; pi – парциальное давление i -го вещества; р 0 = =1, 013× 105 Па – стандартное давление; сi – молярная концентрация i -го вещества; с 0=1 моль/л – стандартная концентрация.
– безразмерная концентрация i -го вещества; Xi – мольная доля i -го вещества; pi – парциальное давление i -го вещества; р 0 = =1, 013× 105 Па – стандартное давление; сi – молярная концентрация i -го вещества; с 0=1 моль/л – стандартная концентрация.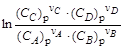 = 0,
= 0,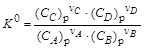 .
.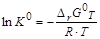 ,
,  ,
,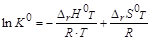 .
.


